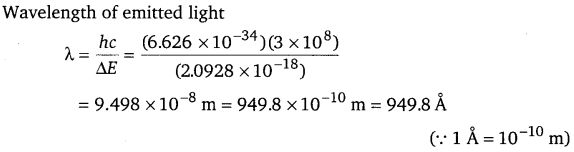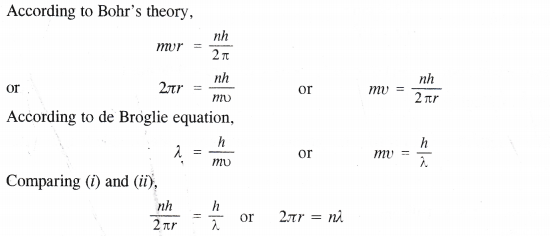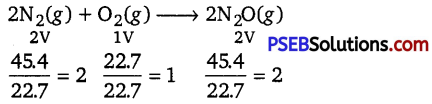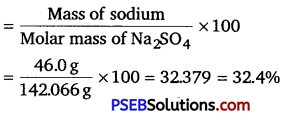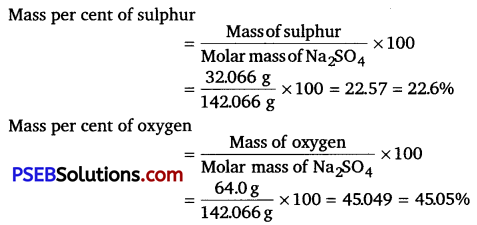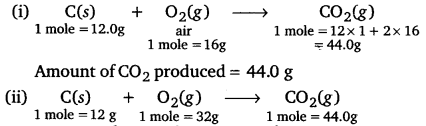Punjab State Board PSEB 11th Class Chemistry Book Solutions Chapter 3 Classification of Elements and Periodicity in Properties Textbook Exercise Questions and Answers.
PSEB Solutions for Class 11 Chemistry Chapter 3 Classification of Elements and Periodicity in Properties
PSEB 11th Class Chemistry Guide Classification of Elements and Periodicity in Properties InText Questions and Answers
Question 1.
What is the basic theme of organisation in the periodic table?
Answer:
The basic theme of organisation of elements in the periodic table is to classify the elements in periods and groups according to their properties. This arrangement makes the study of elements and their compounds simple and systematic. In the periodic table, elements with similar properties are placed in the same group.
Question 2.
Which important property did Mendeleev use to classify the elements in his periodic table and did he stick to that? ‘
Answer:
Mendeleev arranged the elements in his periodic table ordered by atomic weight or mass. He arranged the elements in periods and groups in order of their increasing atomic weight. He placed the elements with similar properties in the same group.
However, he did not stick to this arrangement for long. He found out that if the elements were arranged strictly in order of their increasing atomic weights, then some elements did not fit within this scheme of classification. Therefore, he ignored the order of atomic weights in some cases. For example, the atomic weight of iodine is lower than that of tellurium. Still Mendeleev placed tellurium (in Group VI) before iodine (in Group VII) simply because iodine’s properties are so similar to fluorine, chlorine and bromine.
![]()
Question 3.
What is the basic difference in approach between the Mendeleev’s Periodic Law and the Modem Periodic Law?
Answer:
Mendeleev’s periodic law : It states that the properties of the elements are a periodic function of their atomic weights.
Modern periodic law : It states that the properties of the elements are a periodic function of their atomic numbers.
Thus, change in the base of classification of elements from atomic weight to atomic number is the basic difference between Mendeleev’s periodic law and the modern periodic law.
Question 4.
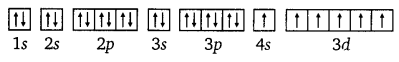
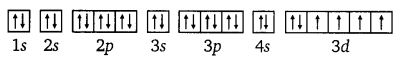
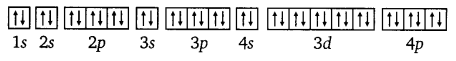
On the basis of quantum numbers, justify that the sixth period of the periodic table should have 32 elements.
Answer:
In the periodic table of the elements, a period indicates the value of the principal quantum number (n) for the outermost shells. Each period begins with the filling of principal quantum number (n). The value of n for the sixth period is 6. For n = 6, azimuthal quantum number (0 can have values of 0, 1, 2, 3, 4, 5.
According to Aufbau’s principle, electrons are added to different orbitals in order of their increasing energies. The energy of the 6d subshell is even higher than that of the 7s subshell.
In the 6th period, electrons can be filled in only 6s, 4f, 5d and 6p subshells. Now 6s has one orbital, 4f has seven orbitals, 5d has five orbitals, and 6p has three orbitals. Therefore, there are a total of sixteen (1+ 7 + 5 + 3 = 16) orbitals available. According to Pauli’s exclusion principle, each orbital can accommodate a maximum of 2 electrons. Thus, 16 orbitals can accommodate a maximum of 32 electrons.
Hence, the sixth period of the periodic table should have 32 elements.
Question 5.
In terms of period and group where would you locate the element with Z = 114?
Answer:
114Z = 86[Rn] 7s2, 5f14, 6d10, 7p2
In the periodic table the element with Z = 114 is located in
Block : p-block (as last electron enters in p-subshell).
Period : 7th (as n = 7 for valence shell).
Group : 14th (for p-block elements, group number = 10 + number of electrons in the valence shell).
Question 6.
Write the atomic number of the element present in the third period and seventeenth group of the periodic table.
Answer:
There are two elements in the 1st period and eight elements in the 2nd period. The third period starts with the element with Z = 11. Now, there are eight elements in the third period. Thus, the 3rd period ends with the element with Z = 18 i.e., the element in the 18th group of the third period has Z = 18. Hence, the element in the 17th group of the third period has atomic number Z = 17.
Question 7.
Which element do you think would have been named by
(i) Lawrence Berkeley Laboratory
(ii) Seaborg’s group.
Answer:
(i) Lawrencium (Lr) with Z = 103 and Berkelium (Bk) with Z = 97
(ii) Seaborgium (Sg) withZ = 106 ,
Question 8.
Why do elements in the same group have similar physical and chemical properties?
Answer:
Same group elements have similar electronic configuration therefore, have similar physical and chemical properties.
![]()
Question 9.
What does atomic radius and ionic radius really mean to you?
Answer:
Atomic radius is the radius of an atom. It measures the size of an atom. If the element is a metal, then the atomic radius refers to the metallic radius, and if the element is a non-metal, then it refers to the covalent radius.
Metallic radius is calculated as half the internuclear distance separating the metal cores in the metallic crystal. For example, the internuclear distance between two adjacent copper atoms in solid copper is 256 pm. Thus, the metallic radius of copper is taken as \(\frac{256}{2}\) pm = 128 pm.
Covalent radius is measured as the distance between two atoms when they are found together by a single bond in a covalent molecule. For example, the distance between two chlorine atoms in chlorine molecule is 198 pm. Thus, the covalent radius of chlorine is taken as \(\frac{198}{2}\)pm = 99 pm.
Ionic radius means the radius of an ion (cation or anion). The ionic radii can be calculated by measuring the distances between the cations and anions in ionic crystals.
Since a cation is formed by removing an electron from an atom, the cation has fewer electrons than the parent atom resulting in an increase in the effective nuclear charge. Thus, a cation is smaller than the parent atom. For example, the ionic radius of Na+ ion is 95 pm, whereas the atomic radius of Na atom is 186 pm. On the other hand, an anion is larger in size than its parent atom. This is because an anion has the same nuclear charge, but more electrons than the parent atom resulting in an increased repulsion among the electrons and a decrease in the effective nuclear charge. For example, the ionic radius of F– ion is 136 pm, whereas the atomic radius of F atom is 64 pm.
Question10.
How do atomic radius vary in a period and in a group? How do you explain the variation?
Answer:
Atomic radius generally decreases from left to right across a period. This is because within a period, the outer electrons are present in the same valence shell and the atomic number increases from left to right across a period, resulting in an increased effective nuclear charge. As a result, the attraction of electrons to the nucleus increases.
On the other hand, the atomic radius generally increases down a group. This is because down a group, the principal quantum number (n) increases which results in an increase of the distance between the nucleus and valence electrons.
Question 11.
What do you understand by isoelectronic species? Name a species that will be isoelectronic with each of the following atoms or ions.
(i) F– (ii) Ar (iii) Mg2+ (iv) Rb+
Answer:
Atoms and ions having the same number of electrons but different nuclear charges are called isoelectronic species. In case of isoelectronic species, as the nuclear charge increases their size decreases.
(i) F– ion has 9+1 = 10 electrons.
(ii) Ar has 18 electrons.
(iii) Mg2+ ion has 12 – 2 = 10 electrons.
(iv) Rb+ ion has 37 -1 = 36 electrons.
Question12.
Consider the following species :
N3-, 02-, F–, Na+, Mg2+ and Al3+
(a) What is common in them?
(b) Arrange them in the order of increasing ionic radii.
Ans. (i) All the given species have same number of electrons (10e–). Therefore, all are isoelectronic.
(ii) The ionic radii of isoelectronic species decreases with increase in atomic number (as magnitude of the nuclear charge increases with increase in atomic number). Therefore, their ionic radii increase in the order.
Isoelectronic ions = Al3+ < Mg2+ < Na+ < F– < O2- < N3-
Atomic number =13 12 11 9 8 7
![]()
Question 13.
Explain why cations are smaller and anions larger in radii than their parent atoms?
Answer:
A cation has a fewer number of electrons than its parent atom, while its nuclear charge remains the same. As a result, the attraction of electrons to the nucleus is more in a cation than in its parent atom. Therefore, a cation is smaller in size than its parent atom.
On the other hand, an anion has one or more electrons than its parent atom, resulting in an increased repulsion among the electrons and a decrease in the effective nuclear charge. As a result, the distance between the valence electrons and the nucleus is more in anions than in its parent atom. Hence, an anion is larger in radius than its parent atom.
Question 14.
What is the significance of the terms-‘isolated gaseous atom’ and ‘ground state’ while defining the ionization enthalpy and electron gain enthalpy?
Answer:
Ionization enthalpy : It is the minimum amount of energy required to remove an electron from an isolated gaseous atom (A) in its ground state.
X(g) → X+ (g) + e–
The force by which an electron is attracted by nucleus is also affected by the presence of other atoms within its molecule or in the neighbourhood. Therefore, ionization enthalpy is determined in gaseous state because in gaseous state interatomic distances are larger and interatomic forces of attractions are minimum. Further more, ionization enthalpy is determined at a low pressure because it is not possible to isolate a single atom but interatomic attractions can be further reduced by reducing pressure. Due to these reasons, the term isolated gaseous atom in ground state has been included in definition of ionization enthalpy.
Electron gain enthalpy : It is the energy released when an isolated gaseous atom (X) in ground state gains an electron to form gaseous anion.
X(g) + e– → X– (g)
The most stable state of an atom is ground state. If isolated gaseous atom is in excited state, comparatively lesser energy will be released on addition of an electron. So, electron gain enthalpies of gaseous atoms must be determined in their ground states. Therefore, the terms ground state and isolated gaseous atom (explained above) has been also included in the definition of electron gain enthalpy.
Question 15.
Energy of an electron in the ground state of the hydrogen atom is -2.18 x 10-18J. Calculate the ionization enthalpy of atomic hydrogen in terms of J mol-1.
Answer:
It is given that the energy of an electron in the ground state of the hydrogen atom is -2.18 x 10-18 J.
Therefore, the energy required to remove that electron from the ground state of hydrogen atom is 2.18 x 10-18 J.
∴ Ionization enthalpy of atomic hydrogen = 2.18 x 10-18 J
Hence, ionization enthalpy per mol of hydrogen atoms
= 2.18 x 10-18 x 6.022 x 1023 J mol-1
= 1.31 x 106 J mol-1
Question16.
Among the second period elements the actual ionization enthalpies are in the order Li < B < Be < C < Cl < N < F < Ne. Explain why
(i) Be has higher A^H than B
(ii) O has lower AjH than N and F?
Answer:
(i) ΔiH of Be is higher than that of B .
Electronic configuration of Be is 1s2, 2s2
whereas that of B is 1s2, 2s2, 2px1
In the case of Be, electron has to be removed from an s-orbital whereas in the case of B, it has to be removed from a p-orbital. It is difficult to remove an s-electron because it is closer to the nucleus than a p-electron hence more energy is required to remove an electron from 2s and Be, than 2p-electron in the case of B. Hence, ionization enthalpy of Be is higher than that of B.
(ii) Electronic configuration of O is
1s2, 2s2, \(2 p_{x}^{2} 2 p_{y}^{1} 2 p_{z}^{1}\) (neither exactly half-filled nor completely filled)
whereas N is 1s2, 2s2, \(2 p_{x}^{1} 2 p_{y}^{1} 2 p_{z}^{1}\) (exactly half-filled)
It is difficult to remove an electron from the valence shell of N because its p-subshell is exactly half-filled and so has more stability whereas O has electronic configuration which is neither completely filled nor exactly half-filled. Therefore, it is easier to remove one electron from O atom. F, due to increased nuclear charge, has more ionization enthalpy than either O or N.
Question17.
How would you explain the fact that the first ionization enthalpy of sodium is lower than that of magnesium but its second ionization enthalpy is higher than that of magnesium?
Answer:
The first electron in both the cases has to be removed from 3s orbital, but nuclear charge of Na is less than that of Mg. Hence ionization enthalpy of Na is lower than that of Mg.
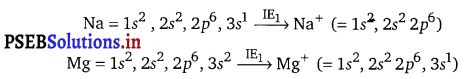
After the loss of first electron the electronic configuration of Na+ is 1s2, 2s2, 2p6, i.e., that of noble gas which is very stable and hence the removal of second electron from Na+ is very difficult. In the case of Mg after the loss of first electron, electronic configuration of Mg+ ion is 1s2 , 2s2 2p6 , 3s1 . The second electron to be removed is from 3s orbital which is easier.
Hence, second ionization enthalpy of sodium is much larger than second . ionization enthalpy of Mg.
![]()
Question 18.
What are the various factors due to which the ionization enthalpy of the main group elements tends to decrease down a group?
Answer:
The factors responsible for the ionization enthalpy of the main group elements to decrease down a group are listed below:
(i) Atomic size : On moving down the group atomic size increases due to addition of new higher energy shell. As a result, force of attraction of nucleus for valence electrons decreases and ionization enthalpy also decreases.
(ii) Screening effect : On moving down the group, screening effect or shielding effect increases so ionization enthalpy decreases.
Question19.
The first ionization enthalpy values (in kJ mol-1) of group 13 elements are :
![]()
How would you explain this deviation from the general trend?
Answer:
On moving down a group, ionization enthalpy generally decreases due to an increase in the atomic size and shielding. Thus, on moving down group 13, ionization enthalpy decreases from B to Al. But, Ga has higher ionization enthalpy than Al. Al follows immediately after s-block elements, whereas Ga follows after d-block elements. The shielding provided by d-electrons is not very effective. These electrons do not shield the valence electrons very effectively. As a result, the valence electrons of Ga experience a greater effective nuclear charge than those of Al. Further, moving from Ga to In, the ionization enthalpy decreases due to an increase in the atomic size and shielding. But, on moving from In to Tl, the ionization enthalpy again increases. In the periodic table, Tl follows after 4f and Ad electrons. The shielding provided by the electrons in both these orbitals is not very effective. Therefore, the valence electron is held quite strongly by the nucleus. Hence, the ionization energy of Tl is on the higher side.
Question20.
Which of the following pairs of elements would have more negative electron gain enthalpy?
(i) OorF (ii) F or Cl
Answer:
(i) O and F are present in the same period of the periodic table. An F atom has one proton and one electron more than O and as an electron is being added to the same shell, the atomic size of F is smaller than that of O. As F contains one proton more than O, its nucleus can attract the incoming electron more strongly in comparison to the nucleus of O atom. Also, F needs only one more electron to attain the stable noble gas configuration. Hence, the electron gain enthalpy of F is more negative (- 328 kJ mol-1) than that of O (-141 kJ mol-1).
(ii) F and Cl belong to the same group of the periodic table. The electron gain enthalpy usually becomes less negative on moving down a group.
However, in this case, the value of the electron gain enthalpy of Cl is more negative than that of F. This is because the atomic size of F is smaller than that of Cl. In F, the electron will be added to quantum level n = 2, but in Cl, the electron is added to quantum level n = 3. Therefore, there are less electron-electron repulsion in Cl and an additional electron can be accommodated easily. Hence, the electron gain enthalpy of Cl is more negative (- 349kJ mol-1) than that of F (-328kJ mol-1).
Question 21.
Would you expect the second electron gain enthalpy of O as positive, more negative or less negative than the first? Justify your answer.
Answer:
When an electron is added to O atom to form O– ion, energy is released. Thus, the first electron gain enthalpy of O is negative.
0(g) + e– → O– (g); ΔegH = -141 kJ mol-1
On the other hand, when an electron is added to O ion to form O ion, energy has to be given out in order to overcome the strong electronic repulsion. Thus, the second electron gain enthalpy of O is positive.
O–(g) + e– → O2-(g); ΔegH = +780 kJ mol-1
Question 22.
What is the basic difference between the terms electron gain enthalpy and electronegativity? •
Answer:
Electron gain enthalpy is the measure of the tendency of an isolated gaseous atom to accept an electron, whereas electronegativity is the measure of the tendency of an atom in a chemical compound to attract a shared pair of electrons.
Question 23.
How would you react to the statement that the electronegativity of N on Pauling scale is 3.0 in all the nitrogen compounds?
Answer:
On Pauling scale, the electronegativity of nitrogen, (3.0) indicates that it is sufficiently electronegative. But it is not correct to say that the electronegativity of nitrogen in all the compounds is 3. It depends upon its state of hybridisation in a particular compound, greater the percentage of s-character, more will be the electronegativity of the element. Thus, the electronegativity of nitrogen increases in moving from sp3 hybridised orbitals to sp hybridised orbitals i.e., as sp3 < sp2 < sp.
Question 24.
Describe the theory associated with the radius of an atom as it
(a) gains an electron
(b) loses an electron
Answer:
(a) When an atom gains an electron, its size increases. When an electron is added, the number of electrons goes up by one. This results in an increase in repulsion among the electrons. However, the number of protons remains the same. As a result, the effective nuclear charge of the atom decreases and the radius of the atom increases. For example, ionic radius of Cl– ion is greater than the radius of its parent atom Cl.

![]()
(b) When an atom loses an electron, the number of electrons decreases by one while the nuclear charge remains the same. Therefore, the interelectronic repulsions in the atom decrease. As a result, the effective nuclear charge increases. Hence, the radius of the atom decreases.
For example, ionic radius of Na+ is smaller than the radius of its parent atom Na.
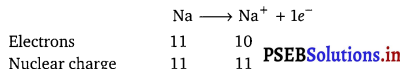
Question 25.
Would you expect the first ionization enthalpies for two isotopes of the same element to be the same or different? Justify your answer.
Answer:
The ionization enthalpy of an atom depends on the number of electrons and protons (nuclear charge) of that atom. Now, the isotopes of an element have the same number of protons and electrons. Therefore, the first ionization enthalpy for two isotopes of the same element should be the same.
Question 26.
What are the major differences between metals and non-metals?
Answer:
| Metals | Non-metals |
| 1. Metals can lose electrons easily. | Non-metals cannot lose electrons easily. |
| 2. Metals cannot gain electrons easily. | Non-metals can gain electrons easily. |
| 3. Metals generally form ionic compounds. | Non-metals generally form covalent compounds. |
| 4. Metal oxides are basic in nature. | Non-metal oxides are acidic in nature. |
| 5. Metals have low ionization enthalpies. | Non-metals have high ionization enthalpies. |
| 6. Metals have less negative electron gain enthalpies. | Non-metals have high negative electron gain enthalpies. |
| 7. Metals are less electronegative. They are rather electropositive elements. | Non-metals are electronegative. |
| 8. Metals have a high reducing power. | Non-metals have a low reducing power. |
Question27.
Use the periodic table to answer the following questions.
(a) Identify an element with five electrons in the outer subshell.
(b) Identify an element that would tend to lose two electrons.
(c) Identify an element that would tend to gain two electrons.
(d) Identify the group having metal, non-metal liquid as well as gas at the room temperature.
Answer:
(a) General electronic configuration of elements having five electrons in the outer sub shell is ns2 np . This configuration belongs to halogen family, i.e., F, Cl, Br, I, At.
(b) Elements of second group are known as alkaline earth metals (Mg, Ca, Sr, Ba, etc). Their general electronic configuration for valence shell is ns2. These elements form dipositive cations by the lose of two electrons easily.
(c) 16th group elements such as O, S, Se, etc., have a tendency to accept two electrons because by the gain of two electrons they attain noble gas configuration. Their general electronic configuration for valence shell is ns2 np4.
(d) Group 1 or 17 of the periodic table contains metal, non-metal, liquid as well as gas at the room temperature, e.g., H2 is a non-metal and in gaseous state at room temperature. All other elements of this group are metals. Cs is a liquid metal. Similarly, Br2 is a liquid non-metal while other elements of this group are gaseous non-metals. Iodine can form I+ so it consists some metallic properties.
Question 28.
The increasing order of reactivity among group 1 elements is Li < Na < K < Rb < Cs whereas that among group 17 elements is F > Cl > Br > I. Explain.
Answer:
The elements present in group 1 have only 1 valency electron, which they tend to lose. Group 17 elements, on the other hand, need only one electron to attain the noble gas configuration. On moving down group 1, the ionization enthalpies decrease. This means that the energy required to lose the valence electron decreases. Thus reactivity increases on moving down a group. Thus, the increasing order of ( reactivity among group 1 elements is as follows :
Li < Na < K < Rb < Cs In group 17, as we move down the group from Cl to I, the electron gain enthalpy becomes less negative i. e., its tendency to gain electrons decreases on moving down a group. Thus, reactivity decreases down a group. The electron gain enthalpy of F is less negative than Cl. Still, it is the most reactive halogen. This is because of its low bond dissociation energy. Thus, the decreasing order of reactivity among group 17 elements is as follows : F > Cl > Br > I.
![]()
Question 29.
Write the general outer electronic configuration of s-, p-, d- and f- block elements.
Answer:
| Element | General outer electronic configuration |
| s-block | ns1-2, where n = 2 – 7 |
| p-block | ns2 np1-6 , where n = 2 – 6 |
| d-block | (n – 1)d1–10ns(0 – 2), where n = 4 – 7 |
| f-block | (n – 2)f1–14 (n – 1)d0- 1ns2, where n = 6 – 7 |
Question30.
Assign the position of the element having outer electronic configuration
(i) ns2 np4 for n = 3 (ii) (n – 1 )d2ns2 for n = 4, and
(iii) (n – 2)f7(n – 1)d1ns2 for n = 6, in the periodic table.
Answer:
(i) ns2np4 for n = 3; it is 3s23p4
The complete electronic configuration is 1s2, 2s2, 2p6, 3s2, 3p4
Atomic number = 2 + 2+ 6+ 2 + 4 = 16
The element is sulphur in the 3rd period and in Group 16 (p-block)
(ii) (n – 1)d2ns2 for n = 4; it is 3d24s2
The complete electronic configuration is
1s2, 2s2,2p6, 3s2, 3p6, 3d2, 4s2 Atomic number is 22, the element is Titanium.
It is a transition element present in the 4th period and in Group 4.
(iii) (n – 2)f7(n – l)d1ns2 for n = 6; it is 4f75d16s2
Its complete electronic configuration is
1s2, 2s2, 2p6, 3s2, 3p6, 3d10, 4s2, 4p6, 4d10, 4f7, 5s2, 5p6, 5d1, 6s2
It is Gadolinium (Gd)
It is an inner transition element, belongs to Lanthanoid series or 4f series. It is an f-block element.
Question 31.
The first (Δi,H1) and the second (ΔiH2) ionization enthalpies (in kJ mol-1) and the (ΔegH) electron gain enthalpy (in kJ mol-1) of a few elements are given below:
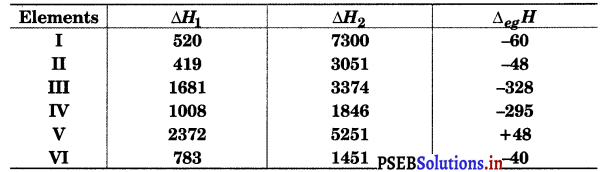
Which of the above elements is likely to be :
(a) the least reactive element.
(b) the most reactive metal.
(c) the most reactive non-metal
(d) the least reactive non-metal.
(e) the metal which can form a stable binary halide of the formula MX2 (X = halogen).
(f) the metal which can form a predominantly stable covalent halide of the formula MX (X = halogen)?
Answer:
(a) Element V is likely to be the least reactive element. This is because it has the highest first ionization enthalpy (Δi,H1) and a positive electron gain enthalpy (Δeg,H1).
(b) Element II is likely to be the most reactive metal as it has the lowest first ionization enthalpy (Δi,H1) and the highest negative electron gain enthalpy (AegH).
(c) Element III is likely to be the most reactive non-metal as it has a high first ionization enthalpy Δi,H1) and the highest negative electron gain enthalpy (Δeg,H).
(d) Element IV is likely to be the least reactive non-metal since it has a very high first ionization enthalpy (Δi,H2) and a positive electron gain enthalpy (Δeg,H).
(e) Element VI has a low negative electron gain enthalpy (Δeg,H). Thus it is a metal. Further, it has the lowest second ionization enthalpy (Δi,H2). Hence, it can form a stable binary halide of the formula MX2 ( X = halogen).
(f) Element I has low Δi,H1 but a very high Δi,H2. It has less negative electron gain enthalpy. So, element (I) is alkali metal. The given values for element I match with Li. Lithium firms predominantly stable covalent halide of the formula Mx.
Question32.
Predict the formulas of the stable binary compounds that would be formed by the combination of the following pairs of elements.
(a) Lithium and oxygen
(b) Magnesium and nitrogen
(c) Aluminium and iodine
(d) Silicon and oxygen
(e) Phosphorus and fluorine
(f) Element 71 and fluorine
Answer:
(a) Li20
(b) Mg3N2
(c) AlI3
(d) SiO2
(e) PF3 or PF5
(f) The element with the atomic number 71 is Lutetium (Lu). It has valency 3. Hence, the formula of the compound is LuF3.
![]()
Question 33.
In the modem periodic table, the period indicates the value of:
(a) atomic number
(b) atomic mass
(c) principal quantum number
(d) azimuthal quantum number.
Answer:
(c) The value of the principal quantum number (n) for the outermost shell or the valence shell indicates a period in the Modern periodic table.
Question 34.
Which of the following statements related to the modem periodic table is incorrect?
(a) The p-block has 6 columns, because a maximum of 6 electrons can occupy all the orbitals in a p-shell.
(b) The df-block has 8 columns, because a maximum of 8 electrons can occupy all the orbitals in a d-subshell.
(c) Each block contains a number of columns equal to the number of electrons that can occupy that subshell.
(d) The block indicates value of azimuthal quantum number (l) for the last subshell that received electrons in building up the electronic configuration.
Answer:
The statement (b) is incorrect. The correct statement (b) is that the d-block has 10 columns because a maximum of 10 electrons can occupy all the orbitals in a d-subshell.
All other given statements are correct.
Question 35.
Anything that influences the valence electrons will affect the chemistry of the element. Which one of the following factors does not affect the valence shell?
(a) Valence principal quantum number (n)
(b) Nuclear charge (Z)
(c) Nuclear mass
(d) Number of core electrons.
Answer:
(c) Nuclear mass (protons + neutrons) does not affect the valence shell, only protons i. e., nuclear charge affects the valence shell.
Question 36.
The size of isoelectronic species F–, Ne and Na+ is affected by
(a) Nuclear charge (Z)
(b) Valence principal quantum number (n)
(c) Electron-electron interaction in the outer orbitals.
(d) None of the factors because their size is same.
Answer:
(a) The size of an isoelectronic species increases with a decrease in the nuclear charge (Z).
Question 37.
Which one of the following statements is incorrect in relation to ionization enthalpy?
(a) Ionization enthalpy increases for each successive electron.
(b) The greatest increase in ionization enthalpy is experienced on removal of electron from core noble gas configuration.
(c) End of valence electrons is marked by a big jump in ionization enthalpy.
(d) Removal of electron from orbitals bearing lower n value is easier than from orbital having higher n value.
Answer:
(d) Electrons in orbitals bearing a lower n value are more attracted to the nucleus than electrons in orbitals bearing a higher n value. Hence, the removal of electrons from orbitals bearing a higher n value is easier than the removal of electrons from orbitals having a lower n value.
Question 38.
Considering the elements B, Al, Mg and K the correct order of their metallic character is:
(a) B > Al > Mg > K
(b) Al > Mg > B > K
(c) Mg > Al > K > B
(d) K > Mg > Al > B
Answer:
(d) In a group, metallic character increases from top to bottom as ; ionisation energy decreases and in a period metallic character decreases from left to right as tendency to lose electron decreases. Therefore, the correct order is K > Mg > Al > B.
Question 39.
Considering the elements B, C, N, F and Si the correct order of their non-metallic character is
(a) B > C > Si > N > F
(b) Si > C > B > N > F
(c) F > N > C > B > Si
(d) F > N > C > Si > B
Answer:
(c) The non-metallic character of elements increases from left to right across a period. Thus, the decreasing order of non-metallic character is F > N > c > B.
Again, the non metallic character of elements decreases down a group. ;
Thus, the decreasing order of non-metallic characters of C and Si are C > Si. However, Si is less non-metallic than B i.e., B > Si.
Hence, the correct order of non-metallic characters is F > N > C > B > Si.
![]()
Question 40.
Considering the elements F, Cl, O and N the correct order of their chemical reactivity in terms of oxidizing property is :
(a) F > Cl > O > N
(b) F > O > Cl > N
(c) Cl > F > O > N
(d) O > F > N > Cl
Answer:
(b) In a group, oxidising power decreases from top to bottom as the size increases but when we move left to right in a period it increases because size decreases.
Therefore, among F, Cl, O and N, the oxidising power decreases in the order F > O > Cl > N.