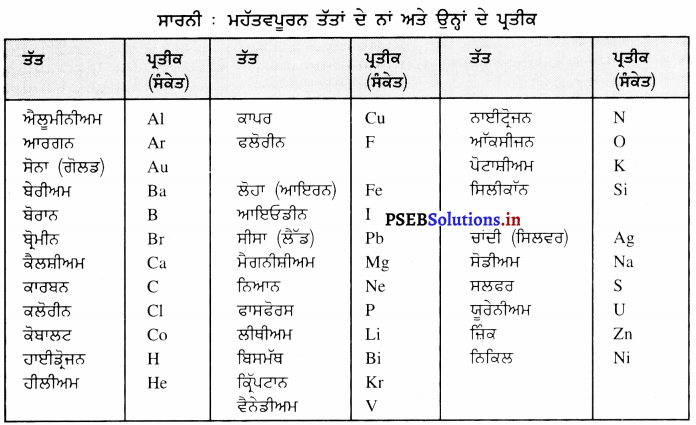
Punjab State Board PSEB 9th Class Science Book Solutions Chapter 3 ਪਰਮਾਣੂ ਅਤੇ ਅਣੂ Textbook Exercise Questions and Answers.
PSEB Solutions for Class 9 Science Chapter 3 ਪਰਮਾਣੂ ਅਤੇ ਅਣੂ
PSEB 9th Class Science Guide ਪਰਮਾਣੂ ਅਤੇ ਅਣੂ Textbook Questions and Answers
ਅਭਿਆਸ ਦੇ ਪ੍ਰਸ਼ਨ
ਪ੍ਰਸ਼ਨ 1.
0.24g ਆਕਸੀਜਨ ਅਤੇ ਬੋਰਾਂਨ ਯੁਕਤ ਯੌਗਿਕ ਦੇ ਨਮੂਨੇ ਵਿੱਚ ਵਿਸ਼ਲੇਸ਼ਣ ਦੁਆਰਾ ਇਹ ਵੇਖਿਆ ਗਿਆ ਕਿ ਇਸ ਵਿੱਚ 0.096g ਬੋਰਾਂਨ ਅਤੇ 0.144g ਆਕਸੀਜਨ ਹੈ । ਉਸ ਯੌਗਿਕ ਦੇ ਪ੍ਰਤੀਸ਼ਤ ਬਣਤਰ ਦੀ ਭਾਰ ਰੂਪ ਵਿੱਚ ਗਣਨਾਂ ਕਰੋ ।
ਹੱਲ :
ਦਿੱਤੇ ਹੋਏ ਯੌਗਿਕ ਦਾ ਪੁੰਜ = 0.24g
ਯੋਗਿਕ ਵਿੱਚ ਮੌਜੂਦ ਬੋਰਾਨ ਦਾ ਪੁੰਜ = 0.096g
ਯੌਗਿਕ ਵਿੱਚ ਮੌਜੂਦ ਆਕਸੀਜਨ ਦਾ ਪੁੰਜ = 0. 144g
ਨਮੂਨੇ ਵਿੱਚ ਬੋਰਾਨ (B) ਦੀ ਪ੍ਰਤੀਸ਼ਤਤਾ (%) = \(\frac{0.096}{0.24}\) × 100
\(\frac{96}{240}\) × 100
= 40
ਨਮੂਨੇ ਵਿੱਚ ਆਕਸੀਜਨ (O) ਦੀ ਪ੍ਰਤੀਸ਼ਤਤਾ (%) = \(\frac{0.144}{0.24}\) × 100
= 60
ਪ੍ਰਸ਼ਨ 2.
3.00g ਕਾਰਬਨ, 8.00g ਆਕਸੀਜਨ ਵਿੱਚ ਜਲ ਦੇ 11.00g ਕਾਰਬਨ-ਡਾਈਆਕਸਾਈਡ ਪੈਦਾ ਕਰਦੀ ਹੈ । ਜਦੋਂ 3.0g ਕਾਰਬਨ, 50.00g ਆਕਸੀਜਨ ਵਿੱਚ ਲਵਾਂਗੇ ਤਾਂ ਕਿੰਨੇ ਗ੍ਰਾਮ ਕਾਰਬਨ-ਡਾਈਆਕਸਾਈਡ ਉਪਜੇਗੀ ? ਤੁਹਾਡਾ ਉੱਤਰ ਰਸਾਇਣ ਸੰਯੋਜਨ ਦੇ ਕਿਸ ਨਿਯਮ ‘ਤੇ ਆਧਾਰਿਤ ਹੋਵੇਗਾ ?
ਹੱਲ :
3.00g ਕਾਰਬਨ, 8.00g ਆਕਸੀਜਨ ਵਿੱਚ ਜਲ ਕੇ 11.00g ਕਾਰਬਨ-ਡਾਈਆਕਸਾਈਡ ਪੈਦਾ ਕਰਦੀ ਹੈ । ਇਸ ਤੋਂ ਇਹ ਪਤਾ ਲਗਦਾ ਹੈ ਕਿ ਸਾਰੀ ਕਾਰਬਨ ਅਤੇ ਆਕਸੀਜਨ ਵਰਤੋਂ ਵਿੱਚ ਆਉਣ ਨਾਲ ਕਾਰਬਨ-ਡਾਈਆਕਸਾਈਡ ਉਪਜਦੀ ਹੈ ।
C + O2 → CO2
ਇਸ ਲਈ ਜਦੋਂ ਤg ਕਾਰਬਨ, 50.0g ਆਕਸੀਜਨ ਦੀ ਵਰਤੋਂ ਕੀਤੀ ਜਾਂਦੀ ਹੈ ਤਾਂ ਸਿਰਫ਼ 8g ਆਕਸੀਜਨ ਸੰਜੋਗ ਕਰਕੇ ਕਾਰਬਨ-ਡਾਈਆਕਸਾਈਡ ਬਣਾਉਂਦੀ ਹੈ ਜਦੋਂ ਕਿ ਬਾਕੀ ਆਕਸੀਜਨ ਦਾ ਪ੍ਰਯੋਗ ਨਹੀਂ ਹੁੰਦਾ ਹੈ । ਇਹ ਸਥਿਰ ਅਨੁਪਾਤ ਨਿਯਮ ਨੂੰ ਦਰਸਾਉਂਦਾ ਹੈ ।
ਪ੍ਰਸ਼ਨ 3.
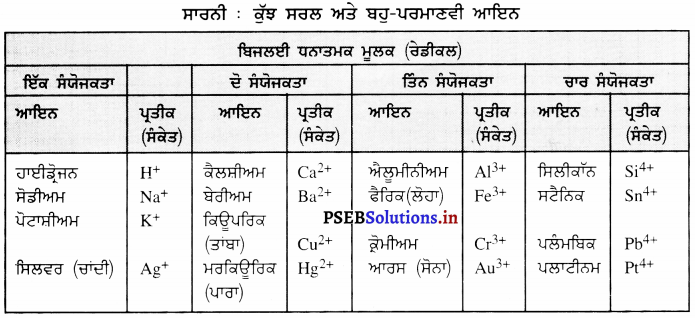
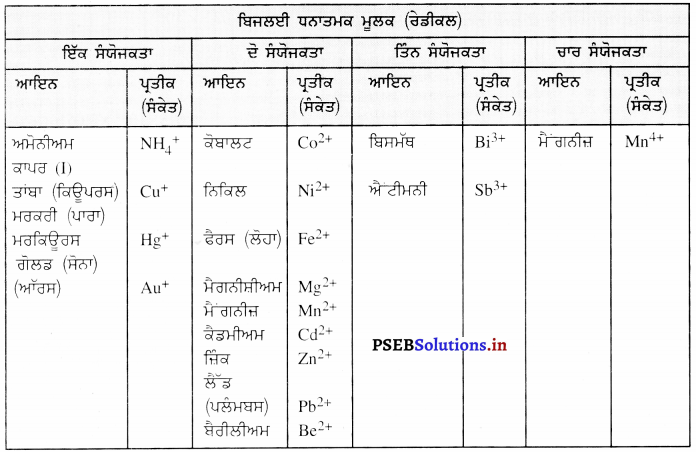
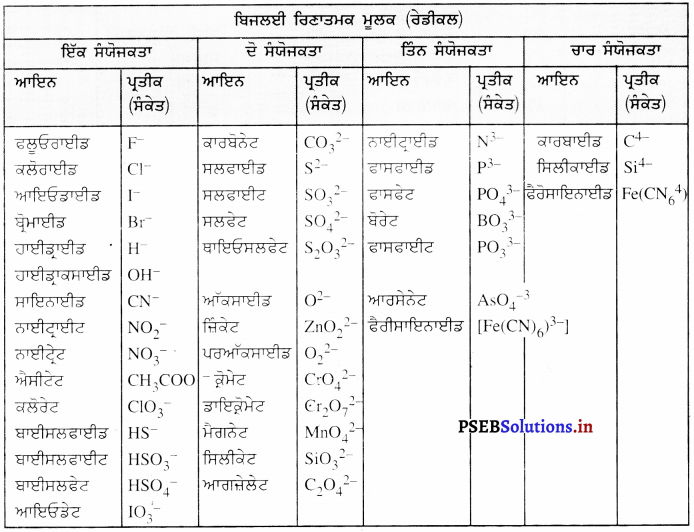
ਬਹੁ-ਪਰਮਾਣਵੀਂ ਆਇਨ ਕੀ ਹੁੰਦੇ ਹਨ ? ਉਦਾਹਰਣਾਂ ਦਿਓ ।
ਉੱਤਰ-
ਬਹੁ-ਪਰਮਾਣਵੀਂ-ਆਇਨ (Poly-atomic Ion) – ਪਰਮਾਣੂਆਂ ਦਾ ਉਹ ਸਮੂਹ ਜੋ ਆਇਨ ਦੀ ਤਰ੍ਹਾਂ ਵਿਵਹਾਰ ਕਰਦਾ ਹੈ, ਉਸਨੂੰ ਬਹੁ-ਪਰਮਾਣਵੀਂ ਆਇਨ ਕਹਿੰਦੇ ਹਨ । ਉਨ੍ਹਾਂ ਉੱਤੇ ਇੱਕ ਨਿਸ਼ਚਿਤ ਚਾਰਜ ਹੁੰਦਾ ਹੈ ।
ਉਦਾਹਰਨ – \(\mathrm{SO}_{4}^{2-}\), \(\mathrm{SO}_{3}^{2-}\), \(\mathrm{NH}_{4}^{+}\), \(\mathrm{CO}_{3}^{2-}\)
![]()
ਪ੍ਰਸ਼ਨ 4.
ਹੇਠ ਲਿਖਿਆਂ ਦੇ ਰਸਾਇਣਿਕ ਸੂਤਰ ਲਿਖੋ :
(ੳ) ਮੈਗਨੀਸ਼ੀਅਮ ਕਲੋਰਾਈਡ
(ਅ) ਕੈਲਸ਼ੀਅਮ ਕਲੋਰਾਈਡ
(ੲ) ਕਾਪਰ ਨਾਈਟ੍ਰੇਟ
(ਸ) ਐਲੂਮੀਨੀਅਮ ਕਲੋਰਾਈਡ
(ਹ) ਕੈਲਸ਼ੀਅਮ ਕਾਰਬੋਨੇਟ ।
ਉੱਤਰ-
ਯੌਗਿਕ – ਰਸਾਇਣਿਕ ਸੂਤਰ
(ਉ) ਮੈਗਨੀਸ਼ੀਅਮ ਕਲੋਰਾਈਡ – MgCl2
(ਅ) ਕੈਲਸ਼ੀਅਮ ਕਲੋਰਾਈਡ – CaCl2
(ੲ) ਕਾਪਰ ਨਾਈਟ੍ਰੇਟ – Cu(NO3 )2
(ਸ) ਐਲੂਮੀਨੀਅਮ ਕਲੋਰਾਈਡ – AlCl3
(ਹ) ਕੈਲਸ਼ੀਅਮ ਕਾਰਬੋਨੇਟ – CaCO3 .
ਪ੍ਰਸ਼ਨ 5.
ਹੇਠ ਲਿਖੇ ਯੌਗਿਕਾਂ ਵਿੱਚ ਮੌਜੂਦ ਤੱਤਾਂ ਦੇ ਨਾਂ ਦਿਓ :
(ਉ) ਬੁੱਝਿਆ ਹੋਇਆ ਚੂਨਾ
(ਅ) ਹਾਈਡ੍ਰੋਜਨ ਬਰੋਮਾਈਡ
(ੲ) ਬੇਕਿੰਗ ਪਾਊਡਰ
(ਸ) ਪੋਟਾਸ਼ੀਅਮ ਸਲਫੇਟ ।
ਉੱਤਰ-
ਯੌਗਿਕਾਂ ਦੇ ਨਾਂ – ਮੌਜੂਦ ਤੱਤਾਂ ਦੇ ਨਾਂ
(ਉ) ਬੁੱਝਿਆ ਹੋਇਆ ਚੂਨਾ – ਕੈਲਸ਼ੀਅਮ ਅਤੇ ਆਕਸੀਜਨ
(ਅ) ਹਾਈਡ੍ਰੋਜਨ ਬਰੋਮਾਈਡ – ਹਾਈਡੋਜਨ ਅਤੇ ਬਰੋਮੀਨ
(ੲ) ਬੈਕਿੰਗ ਪਾਊਡਰ – ਸੋਡੀਅਮ, ਹਾਈਡੋਜਨ, ਕਾਰਬਨ ਅਤੇ ਆਕਸੀਜਨ
(ਸ) ਪੋਟਾਸ਼ੀਅਮ ਸਲਫੇਟ – ਪੋਟਾਸ਼ੀਅਮ, ਸਲਫਰ ਅਤੇ ਆਕਸੀਜਨ ।
ਪ੍ਰਸ਼ਨ 6.
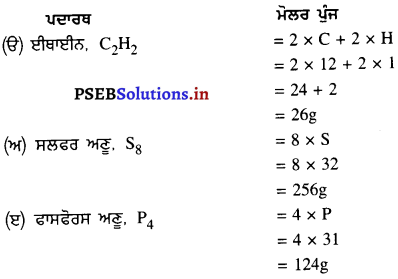
ਹੇਠ ਲਿਖੇ ਪਦਾਰਥਾਂ ਦੇ ਮੋਲਰ ਪੁੰਜ ਦੀ ਗਣਨਾ ਕਰੋ :
(ਉ) ਈਥਾਈਨ, C2H2
(ਅ) ਸਲਫਰ ਅਣੂ, S8
(ਬ) ਫਾਸਫੋਰਸ ਅਣੂ, P4 (ਫਾਸਫੋਰਸ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ = 31)
(ਸ) ਹਾਈਡ੍ਰੋਕਲੋਰਿਕ ਐਸਿਡ, HCl
(ਹ) ਨਾਈਟ੍ਰਿਕ ਐਸਿਡ, HNO3
ਹੱਲ:

ਪ੍ਰਸ਼ਨ 7.
ਹੇਠ ਲਿਖਿਆਂ ਦਾ ਪੁੰਜ ਕੀ ਹੋਵੇਗਾ ?
(ਉ) 1 ਮੋਲ ਨਾਈਟ੍ਰੋਜਨ ਪਰਮਾਣੂ
(ਅ) 4 ਮੋਲ ਐਲੂਮੀਨੀਅਮ ਪਰਮਾਣੂ (ਐਲੂਮੀਨੀਅਮ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ = 27)
(ੲ) 10 ਮੋਲ ਸੋਡੀਅਮ ਸਲਫਾਈਟ (Na2SO3)
ਹੱਲ:
(ੳ) 1 ਮੋਲ ਨਾਈਟ੍ਰੋਜਨ ਪਰਮਾਣੂ ਦਾ ਪੁੰਜ = 14u
= 14g
(ਅ) 1 ਮੋਲ ਐਲੂਮੀਨੀਅਮ ਪਰਮਾਣੂ ਦਾ ਪੁੰਜ = 27 u
∴ 4 ਮੋਲ ਐਲੂਮੀਨੀਅਮ ਪਰਮਾਣੂ ਦਾ ਪੁੰਜ = 27 × 4
= 108u
= 108g
(ੲ) 1 ਮੋਲ ਸੋਡੀਅਮ ਸਲਫਾਈਟ (Na2SO3) ਦਾ ਪੁੰਜ = 2 × Na + 1 × S + 3 × O
= 2 × 23 + 1 × 32 + 3 × 16 = 46 + 32 + 48
= 126 u
∴ 10 ਮੋਲ ਸੋਡੀਅਮ ਸਲਫਾਈਟ ਦਾ ਪੁੰਜ = 10 × 126u
= 1260u
= 1260g.
![]()
ਪ੍ਰਸ਼ਨ 8.
ਮੋਲ ਵਿੱਚ ਬਦਲੋ :
(ਉ) 12g ਆਕਸੀਜਨ ਗੈਸ
(ਅ) 20g ਪਾਣੀ
(ੲ) 22g ਕਾਰਬਨ-ਡਾਈਆਕਸਾਈਡ ।
ਹੱਲ:
ਅਸੀਂ ਜਾਣਦੇ ਹਾਂ ਕਿ ਕਿਸੇ ਵਸਤੂ ਦੇ ਮੋਲਾਂ ਦੀ ਸੰਖਿਆ = 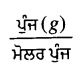
(ਉ) 12g ਆਕਸੀਜਨ ਗੈਸ (O2) ਵਿੱਚ ਮੋਲਾਂ ਦੀ ਸੰਖਿਆ = \(\frac{12}{32}\)
= 0.375
(ਅ) 20g ਪਾਣੀ (HO2) ਵਿੱਚ ਮੋਲਾਂ ਦੀ ਸੰਖਿਆ = \(\frac{20}{18}\)
= \(\frac{10}{9}\)
= 1.11
(ੲ) 22g ਕਾਰਬਨ-ਡਾਈਆਕਸਾਈਡ (CO2) ਵਿੱਚ ਮੋਲਾਂ ਦੀ ਸੰਖਿਆ = \(\frac{22}{44}\)
= \(\frac{1}{2}\)
= 0.5
ਪ੍ਰਸ਼ਨ 9.
ਹੇਠ ਲਿਖਿਆਂ ਦਾ ਪੰਜ ਕੀ ਹੋਵੇਗਾ ?
(ਉ) 0.2 ਮੋਲ ਆਕਸੀਜਨ ਪਰਮਾਣੂ
(ਅ) 0.5 ਮੋਲ ਜਲ ਅਣੂ ?
ਹੱਲ:
(ੳ) 1 ਮੋਲ ਆਕਸੀਜਨ ਪਰਮਾਣੂ ਦਾ ਪੁੰਜ = 16g
∴ 0.2 ਮੋਲ ਆਕਸੀਜਨ ਪਰਮਾਣੂ ਦਾ ਪੁੰਜ = 16g × 0.2
= 3.2g
(ਅ) 1 ਮੋਲ ਜਲ ਅਣੂ ਦਾ ਪੁੰਜ = 18g
0.5 ਮੋਲ ਜਲ ਅਣੂ ਦਾ ਪੁੰਜ = 18g × 0.5
= 9g
![]()
ਪ੍ਰਸ਼ਨ 10.
16g ਠੋਸ ਸਲਫਰ ਵਿੱਚ ਸਲਫਰ (S8) ਦੇ ਅਣੂਆਂ ਦੀ ਸੰਖਿਆ ਦੀ ਗਣਨਾ ਕਰੋ ।
ਹੱਲ:
ਸਲਫਰ S8 ਦੇ 1 ਮੋਲ ਦਾ ਪੁੰਜ = 8 × 32
= 256g
ਅਤੇ S8 ਦੇ 1 ਮੋਲ ਵਿੱਚ ਉਪਸਥਿਤ ਅਣੂਆਂ ਦੀ ਸੰਖਿਆ = 6.023 × 1023
:. 256g ਸਲਫਰ (S8) ਵਿੱਚ ਉਪਸਥਿਤ ਅਣੂਆਂ ਦੀ ਸੰਖਿਆ = 6.023 × 1023
1g ਸਲਫਰ (S8) ਵਿੱਚ ਉਪਸਥਿਤ ਅਣੂਆਂ ਦੀ ਸੰਖਿਆ = \(\frac{6.023 \times 10^{23}}{256}\)
16g ਸਲਫਰ (S8) ਵਿੱਚ ਅਣੂਆਂ ਦੀ ਸੰਖਿਆ = \(\frac{6.023 \times 10^{23} \times 16}{256}\)
= \(\frac{6.023 \times 10^{23}}{16}\)
= 3.76 × 1022
ਪ੍ਰਸ਼ਨ 11.
0.051g ਐਲੂਮੀਨੀਅਮ ਆਕਸਾਈਡ (Al2O3 ਵਿੱਚ ਐਲੂਮੀਨੀਅਮ ਆਇਨ ਦੀ ਸੰਖਿਆ ਦੀ ਗਣਨਾਂ ਕਰੋ | (ਸੰਕੇਤ : ਕਿਸੇ ਆਇਨ ਦਾ ਪੁੰਜ ਓਨਾ ਹੀ ਹੁੰਦਾ ਹੈ ਜਿੰਨਾ ਕਿ ਉਸੇ ਤੱਤ ਦੇ ਪਰਮਾਣੂ ਦਾ ਪੁੰਜ ਹੁੰਦਾ ਹੈ । ਐਲੂਮੀਨੀਅਮ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ = 27u ਹੈ )
ਹੱਲ:
ਐਲੂਮੀਨੀਅਮ ਆਕਸਾਈਡ (Al2O3) ਦਾ 1 ਮੋਲ = 2 × Al + 3 × O
= 2 × 27 + 3 × 16
= 54 + 48
= 102g
102g ਐਲੂਮੀਨੀਅਮ ਆਕਸਾਈਡ ਵਿੱਚ ਮੌਜੂਦ ਅਣੂਆਂ ਦੀ ਸੰਖਿਆ = 6.023 × 1023
1g ਐਲੂਮੀਨੀਅਮ ਆਕਸਾਈਡ ਵਿੱਚ ਮੌਜੂਦ ਅਣੂਆਂ ਦੀ ਸੰਖਿਆ = \(\frac{6.023 \times 10^{23}}{102}\)
∴ 0.051g ਐਲੂਮੀਨੀਅਮ ਆਕਸਾਈਡ ਵਿੱਚ ਮੌਜੂਦ ਅਣੂਆਂ ਦੀ ਸੰਖਿਆ = \(\frac{6.023 \times 10^{23} \times 0.051}{102}\)
= 3.01 × 1020
ਐਲੂਮੀਨੀਅਮ ਆਕਸਾਈਡ (Al2O3) ਜਿੰਨੇ ਆਇਨ ਦਿੰਦਾ ਹੈ = 2Al+++
ਇਸ ਲਈ 0.051gm ਐਲੂਮੀਨੀਅਮ ਆਕਸਾਈਡ ਜਿੰਨੇ ਆਇਨ ਦਿੰਦਾ ਹੈ = 2 × 3.01 × 1020
= 6.02 × 1020
![]()
Science Guide for Class 9 PSEB ਪਰਮਾਣੂ ਅਤੇ ਅਣੂ InText Questions and Answers
ਪਾਠ-ਪੁਸਤਕ ਦੇ ਪ੍ਰਸ਼ਨਾਂ ਦੇ ਉੱਤਰ
ਪ੍ਰਸ਼ਨ 1.
ਇੱਕ ਪ੍ਰਤੀਕਿਰਿਆ ਵਿੱਚ 5.3 g ਸੋਡੀਅਮ ਕਾਰਬੋਨੇਟ ਅਤੇ 6.0 g ਈਥੋਨੋਇਕ ਐਸਿਡ ਕਿਰਿਆ ਕਰਦੇ ਹਨ । 2.2 g ਕਾਰਬਨ-ਡਾਈਆਕਸਾਈਡ, 8.2 g ਸੋਡੀਅਮ ਈਥੋਨੋਏਟ ਅਤੇ 0.9 g ਪਾਣੀ ਉਪਜਾਂ ਦੇ ਰੂਪ ਵਿੱਚ ਪ੍ਰਾਪਤ ਹੁੰਦੇ ਹਨ । ਇਸ ਪ੍ਰਤੀਕਿਰਿਆ ਦੁਆਰਾ ਵਿਖਾਓ ਕਿ ਇਹ ਪਰੀਖਣ ਪੁੰਜ ਸੁਰੱਖਿਅਣ ਨਿਯਮ ਦੇ ਅਨੁਰੂਪ ਹੈ । ਸੋਡੀਅਮ ਕਾਰਬੋਨੇਟ + ਈਥੋਨੋਇਕ ਐਸਿਡ → ਸੋਡੀਅਮ ਈਥੋਨੋਏਟ + ਕਾਰਬਨ-ਡਾਈਆਕਸਾਈਡ + ਪਾਣੀ
ਹੱਲ :
ਸੋਡੀਅਮ ਕਾਰਬੋਨੇਟ ਦਾ ਪੁੰਜ = 5.3g
ਈਥੋਨੋਇਕ ਐਸਿਡ ਦਾ ਪੁੰਜ = 6.0g
ਅਭਿਕਾਰਕਾਂ ਦਾ ਕੁੱਲ ਪੰਜ = ਸੋਡੀਅਮ ਕਾਰਬੋਨੇਟ ਦਾ ਜ + ਈਥੋਨੋਇਕ ਐਸਿਡ ਦਾ ਪੁੰਜ
= 5.3g + 6.0g
= 11.3g ………………… (i)
ਕਾਰਬਨ-ਡਾਈਆਕਸਾਈਡ ਦਾ ਪੁੰਜ = 2.2 g
ਸੋਡੀਅਮ ਈਥੋਨੋਏਟ ਦਾ ਪੁੰਜ = 8.2g
ਪਾਣੀ ਦਾ ਪੁੰਜ = 0.9g
∴ ਉਪਜਾਂ ਦਾ ਕੁੱਲ ਪੰਜ = ਕਾਰਬਨ-ਡਾਈਆਕਸਾਈਡ ਦਾ ਪੁੰਜ + ਸੋਡੀਅਮ ਈਥੋਨੋਏਟ ਦਾ ਪੁੰਜ + ਪਾਣੀ ਦਾ ਪੁੰਜ
= 2.2g + 8.2g + 0.9g
= 11.3g (ii)
ਸਮੀਕਰਨ (i) ਅਤੇ (ii) ਤੋਂ
ਅਭਿਕਾਰਕਾਂ ਦਾ ਕੁੱਲ ਪੰਜ = ਉਪਜਾਂ ਦਾ ਕੁੱਲ ਪੂੰਜ
11.3g = 11.3g
ਇਹ ਪ੍ਰਤੀਕਿਰਿਆ ਪੁੰਜ ਸੁਰੱਖਿਅਣ ਨਿਯਮ ਦੇ ਅਨੁਰੂਪ ਹੈ ।
ਪ੍ਰਸ਼ਨ 2.
ਹਾਈਡ੍ਰੋਜਨ ਅਤੇ ਆਕਸੀਜਨ ਪੁੰਜ ਦੇ ਅਨੁਸਾਰ 1:8 ਦੇ ਅਨੁਪਾਤ ਵਿੱਚ ਸੰਜੋਗ ਕਰਕੇ ਪਾਣੀ ਨਿਰਮਿਤ ਕਰਦੇ ਹਨ । 3g ਹਾਈਡੋਜਨ ਗੈਸ ਦੇ ਨਾਲ ਪੂਰਣ ਰੂਪ ਵਿੱਚ ਸੰਜੋਗ ਕਰਨ ਲਈ ਕਿੰਨੀ ਆਕਸੀਜਨ ਗੈਸ ਦੀ ਜ਼ਰੂਰਤ ਹੋਵੇਗੀ ?
ਉੱਤਰ-
ਕਿਉਂਕਿ ਹਾਈਡੋਜਨ ਅਤੇ ਆਕਸੀਜਨ ਪੁੰਜ ਅਨੁਸਾਰ 1: 8 ਦੇ ਅਨੁਪਾਤ ਵਿੱਚ ਕਿਰਿਆ ਕਰਦੇ ਹਨ ।
∴ xg ਹਾਈਡੋਜਨ ਨੂੰ ਪਾਣੀ ਬਣਨ ਲਈ ਜਿੰਨੀ ਆਕਸੀਜਨ ਦੀ ਮਾਤਰਾ ਦੀ ਲੋੜ ਹੈ = 8 × x g
∴ 3g ਹਾਈਡੋਜਨ ਨੂੰ ਜਿੰਨੀ ਮਾਤਰਾ ਆਕਸੀਜਨ ਦੀ ਜ਼ਰੂਰਤ ਹੈ = 8 × 3 g = 24g
![]()
ਪ੍ਰਸ਼ਨ 3.
ਡਾਲਟਨ ਦੇ ਪਰਮਾਣੂ ਸਿਧਾਂਤ ਦਾ ਕਿਹੜਾ ਨੁਕਤਾ ਪੁੰਜ ਦੇ ਸੁਰੱਖਿਅਣ ਦੇ ਨਿਯਮ ਦਾ ਨਤੀਜਾ ਹੈ ?
ਉੱਤਰ-
“ਪਰਮਾਣੂ ਅਵਿਭਾਜ ਸੂਖ਼ਤਮ ਕਣ ਹੁੰਦੇ ਹਨ ਜੋ ਰਸਾਇਣਿਕ ਪ੍ਰਤੀਕਿਰਿਆ ਵਿੱਚ ਨਾ ਤਾਂ ਸਿਰਜਤ ਹੁੰਦੇ ਹਨ ਅਤੇ ਨਾ ਹੀ ਉਨ੍ਹਾਂ ਦਾ ਵਿਨਾਸ਼ ਹੁੰਦਾ ਹੈ ।”
ਡਾਲਟਨ ਸਿਧਾਂਤ ਦਾ ਇਹ ਨੁਕਤਾ ਪੁੰਜ ਦੇ ਸੁਰੱਖਿਅਣ ਨਿਯਮ ਦਾ ਨਤੀਜਾ ਹੈ ।
ਪ੍ਰਸ਼ਨ 4.
ਡਾਲਟਨ ਦੇ ਪਰਮਾਣੂ ਸਿਧਾਂਤ ਦਾ ਕਿਹੜਾ ਨੁਕਤਾ ਨਿਸਚਿਤ ਅਨੁਪਾਤ ਦੇ ਨਿਯਮ ਦੀ ਵਿਆਖਿਆ ਕਰਦਾ ਹੈ ?
ਉੱਤਰ-
ਡਾਲਟਨ ਦੇ ਪਰਮਾਣੂ ਸਿਧਾਂਤ ਦਾ ਨੁਕਤਾ ਜਿਹੜਾ ਨਿਸਚਿਤ ਅਨੁਪਾਤ ਦੇ ਨਿਯਮ ਦੀ ਵਿਆਖਿਆ ਕਰਦਾ ਹੈ-
“ਕਿਸੇ ਵੀ ਯੌਗਿਕ ਦੇ ਪਰਮਾਣੂਆਂ ਦੀ ਸਾਪੇਖ ਸੰਖਿਆ ਅਤੇ ਕਿਸਮਾਂ ਨਿਸਚਿਤ ਹੁੰਦੀਆਂ ਹਨ ।”
ਪ੍ਰਸ਼ਨ 5.
ਪਰਮਾਣੂ ਪੁੰਜ ਇਕਾਈ ਨੂੰ ਪਰਿਭਾਸ਼ਿਤ ਕਰੋ ।
ਉੱਤਰ-
ਪਰਮਾਣੂ ਪੁੰਜ ਇਕਾਈ (Atomic Mass Unit)-ਇਹ ਕਾਰਬਨ-12 ਸਮਸਥਾਨਿਕ ਦੇ ਇੱਕ ਪਰਮਾਣੂ ਪੁੰਜ ਦਾ \(\frac{1}{12}\)ਵਾਂ ਭਾਗ ਹੈ ।
1 a.m.u. = 1.66 × 10-27 kg
ਪ੍ਰਸ਼ਨ 6.
ਇੱਕ ਪਰਮਾਣੂ ਨੂੰ ਅੱਖਾਂ ਨਾਲ ਵੇਖਣਾ ਕਿਉਂ ਸੰਭਵ ਨਹੀਂ ਹੁੰਦਾ ?
ਉੱਤਰ-
ਪਰਮਾਣੂ ਬਹੁਤ ਛੋਟੇ ਹੁੰਦੇ ਹਨ । ਇਸ ਲਈ ਅੱਖਾਂ ਨਾਲ ਉਹਨਾਂ ਨੂੰ ਵੇਖਣਾ ਸੰਭਵ ਨਹੀਂ ਹੈ । ਬਹੁਤ ਸਾਰੇ ਤੱਤਾਂ ਦੇ ਪਰਮਾਣੂ ਤਾਂ ਸੁਤੰਤਰ ਰੂਪ ਵਿੱਚ ਨਹੀਂ ਵਿਚਰ ਸਕਦੇ ਹਨ । ਇਕ ਪਰਮਾਣੂ ਦਾ ਅਰਧ ਵਿਆਸ 10-10 m ਹੈ ਜਿਸ ਨੂੰ ਆਮ ਤੌਰ ‘ਤੇ ਨੈਨੋਮੀਟਰ ਵਿੱਚ ਮਾਪਿਆ ਜਾਂਦਾ ਹੈ । (1 nm = 10-9 m)
ਪ੍ਰਸ਼ਨ 7.
ਹੇਠ ਲਿਖਿਆਂ ਦੇ ਸੂਤਰ ਲਿਖੋ :
(i) ਸੋਡੀਅਮ ਆਕਸਾਈਡ
(ii) ਐਲੂਮੀਨੀਅਮ ਕਲੋਰਾਈਡ
(iii) ਸੋਡੀਅਮ ਸਲਫਾਈਡ
(iv) ਮੈਗਨੀਸ਼ੀਅਮ ਹਾਈਡ੍ਰੋਕਸਾਈਡ ।
ਉੱਤਰ-
जेंगिव – ਸੂਤਰ
(i) ਸੋਡੀਅਮ ਆਕਸਾਈਡ – Na2O
(ii) ਐਲੂਮੀਨੀਅਮ ਕਲੋਰਾਈਡ – AlCl3
(iii) ਸੋਡੀਅਮ ਸਲਫਾਈਡ – Na2S
(iv) ਮੈਗਨੀਸ਼ੀਅਮ ਹਾਈਡ੍ਰੋਕਸਾਈਡ – Mg (OH)2
ਪ੍ਰਸ਼ਨ 8.
ਹੇਠ ਲਿਖੇ ਸੂਤਰਾਂ ਦੁਆਰਾ ਪ੍ਰਦਰਸ਼ਿਤ ਯੌਗਿਕਾਂ ਦੇ ਨਾਂ ਲਿਖੋ :
(i) Al2 (SO4)3
(ii) CaCl2
(iii) K2 SO4
(iv) KNO3
(v) CaCO3
ਉੱਤਰ-
ਸੂਤਰ – ਯੌਗਿਕ ਦਾ ਨਾਂ
(i) Al2 (SO4)3 – ਐਲੂਮੀਨੀਅਮ ਸਲਫੇਟ
(ii) CaCl2 – ਕੈਲਸ਼ੀਅਮ ਕਲੋਰਾਈਡ
(iii) K2 SO4 – ਪੋਟਾਸ਼ੀਅਮ ਸਲਫੇਟ
(iv) KNO3 – ਪੋਟਾਸ਼ੀਅਮ ਨਾਈਟਰੇਟ
(v) CaCO3 – ਕੈਲਸ਼ੀਅਮ ਕਾਰਬੋਨੇਟ ।
![]()
ਪ੍ਰਸ਼ਨ 9.
ਰਸਾਇਣਿਕ ਸੂਤਰ ਦਾ ਕੀ ਭਾਵ ਹੈ ?
ਉੱਤਰ-
ਰਸਾਇਣਿਕ ਸੂਤਰ (Chemical Formula)-ਕਿਸੇ ਪਦਾਰਥ (ਤੱਤ ਜਾਂ ਯੌਗਿਕ) ਦੇ ਅਣੂ ਨੂੰ ਸੰਕੇਤ ਜਾਂ ਚਿੰਨ੍ਹਾਂ ਦੇ ਰੂਪ ਵਿੱਚ ਪ੍ਰਦਰਸ਼ਿਤ ਕਰਨਾ ਰਸਾਇਣਿਕ ਸੂਤਰ ਅਖਵਾਉਂਦਾ ਹੈ । ਉਦਾਹਰਨ ਵਜੋਂ ਪਾਣੀ ਦੇ ਅਣੂ ਦਾ ਸੂਤਰ H2 0 ਹੈ ।
ਪ੍ਰਸ਼ਨ 10.
ਹੇਠ ਲਿਖਿਆਂ ਵਿੱਚ ਕਿੰਨੇ ਪਰਮਾਣੂ ਹਨ :
(i) H2S ਅਣੂ ਅਤੇ
(ii) \(\mathrm{PO}_{4}^{3-}\) ਆਇਨ ।
ਉੱਤਰ-
(i) H2 S ਦੇ ਇੱਕ ਅਣੂ ਵਿੱਚ ਕੁੱਲ 3 ਪਰਮਾਣੂ ਹੁੰਦੇ ਹਨ ਜਿਨ੍ਹਾਂ ਵਿੱਚੋਂ ਦੋ ਪਰਮਾਣੂ ਹਾਈਡੋਜਨ ਦੇ ਅਤੇ ਇੱਕ ਮਾਣੂ ਸਲਫਰ ਦਾ ਮੌਜੂਦ ਹੁੰਦਾ ਹੈ ।
(ii) \(\mathrm{PO}_{4}^{3-}\) ਆਇਨ ਵਿੱਚ ਕੁੱਲ 5 ਪਰਮਾਣੂ ਹੁੰਦੇ ਹਨ ਜਿਨ੍ਹਾਂ ਵਿੱਚੋਂ 1 ਪਰਮਾਣੂ ਫਾਸਫੋਰਸ ਦਾ ਅਤੇ 4 ਪਰਮਾਣੂ ਮੱਕਸੀਜਨ ਦੇ ਹੁੰਦੇ ਹਨ ।
ਪ੍ਰਸ਼ਨ 11.
ਹੇਠ ਦਿੱਤੇ ਯੌਗਿਕਾਂ ਦੇ ਅਣਵੀਂ ਪੰਜਾਂ ਦੀ ਗਣਨਾ ਕਰੋ :-
H2, O2, Cl2, CO2, CH4, C2H6, C4H2, NH3, ਅਤੇ CH3 OH
ਹੱਲ : H2 ਦਾ ਅਣਵੀਂ ਪੰ ਜ = 2 × ਹਾਈਡੋਜਨ ਦਾ ਪਰਮਾਣੁ ਪੁੰਜ
= 2 × 1
= 2 u
O2 ਦਾ ਅਣਵੀਂ ਪੰਜ = 2 × ਆਕਸੀਜਨ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ
= 2 × 16
= 32 u
Cl2 ਦਾ ਅਣਵੀਂ ਪੰਜ = 2 × ਕਲੋਰੀਨ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ
= 2 × 35.5
= 71 u
CO2 ਦਾ ਅਣਵੀਂ ਪੁੰਜ = 1 ਪਰਮਾਣੂ ਕਾਰਬਨ + 2 ਪਰਮਾਣੂ ਆਕਸੀਜਨ
= 1 × ਕਾਰਬਨ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ + 2 × ਆਕਸੀਜਨ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ
= 1 × 2 + 2 × 16
= 12 + 32
= 44 u
C2H6 ਦਾ ਅਣਵੀਂ ਪੁੰਜ = 2 ਪਰਮਾਣੂ ਕਾਰਬਨ + 6 ਪਰਮਾਣੂ ਹਾਈਡ੍ਰੋਜਨ
= 2 × ਕਾਰਬਨ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ + 6 × ਹਾਈਡੋਜਨ ਦਾ ਪਰਮਾਣੁ ਪੁੰਜ
= 2 × 12 + 6 × 1
= 24 + 6
= 30 u
C2H4 ਦਾ ਅਣਵੀਂ ਪੁੰਜ = 2 ਪਰਮਾਣੂ ਕਾਰਬਨ + 2 ਪਰਮਾਣੂ ਹਾਈਡ੍ਰੋਜਨ
= 2 × ਕਾਰਬਨ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ + 4 ਹਾਈਡੋਜਨ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ
= 2 × 12 + 4 × 1
= 24 + 4
= 28 u
NH3 ਦਾ ਅਣਵੀਂ ਜ = 1 ਪਰਮਾਣੂ ਨਾਈਟ੍ਰੋਜਨ + 3 ਪਰਮਾਣੂ ਹਾਈਡ੍ਰੋਜਨ
= 1 × ਨਾਈਟ੍ਰੋਜਨ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ + 3 × ਹਾਈਡੋਜਨ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ
= 1 × 14 + 3 × 1
= 14 + 3
= 17 u
CH3OH ਦਾ ਅਣਵੀਂ ਪੁੰਜ = 1 × ਕਾਰਬਨ ਦਾ ਪਰਮਾਣੂ + 3 × ਹਾਈਡੋਜਨ ਦਾ ਪਰਮਾਣੂ + 1 × ਆਕਸੀਜਨ
ਦਾ ਪਰਮਾਣੂ + 1 × ਹਾਈਡੋਜਨ ਦਾ ਪਰਮਾਣੂ
= 1 × ਕਾਰਬਨ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ + 3 × ਹਾਈਡੋਜਨ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ + 1 × ਆਕਸੀਜਨ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ + 1 × ਹਾਈਡੋਜਨ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ
= 1 × 12 + 3 × 1 + 1 × 16 + 1 × 1
= 12 + 3 + 16 + 1
= 32 u.
ਪ੍ਰਸ਼ਨ 12.
ਹੇਠਾਂ ਦਿੱਤੇ ਯੌਗਿਕਾਂ ਦੇ ਸੂਤਰ ਇਕਾਈ ਪੁੰਜ ਦੀ ਗਣਨਾ ਕਰੋ :-
ZnO, Na2O ਅਤੇ K2CO3.
ਦਿੱਤਾ ਗਿਆ ਹੈ :
Zn ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ = 65u
Na ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ = 23u
K ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ = 39u
C ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ = 12u
O ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ = 16u ਹੈ ।
ਹੱਲ :
ZnO ਦਾ ਸੂਤਰ ਇਕਾਈ ਪੰਜ = Zn ਦਾ । ਪਰਮਾਣੂ +O ਦਾ । ਪਰਮਾਣੂ
= Zn ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ + O ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ
= 65 + 16
= 81u
Na2O ਦਾ ਸੂਤਰ ਇਕਾਈ ਪੁੰਜ = Na ਦੇ 2 ਪਰਮਾਣੂ + O ਦਾ 1 ਪਰਮਾਣੂ
= 2 × Na ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ + 1 × O ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ
= 2 × 23 + 1 × 16
= 46 + 16
= 62u
K2CO3 ੜ ਦਾ ਸੂਤਰ ਇਕਾਈ ਪੁੰਜ = K ਦੇ 2 ਪਰਮਾਣੂ + C ਦਾ 1 ਪਰਮਾਣੂ + O ਦੇ 3 ਪਰਮਾਣੂ
= 2 × K ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ + 1 xcਦਾ ਪਰਮਾਣੂ ਪੁੰਜ + 3 × O ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ
= 2 × 39 + 1 × 12 + 3 × 16
= 78 + 12 + 48
= 138u.
![]()
ਪ੍ਰਸ਼ਨ 13.
ਜੇ ਕਾਰਬਨ ਦੇ ਪਰਮਾਣੂਆਂ ਦੇ ਇੱਕ ਮੋਲ ਦਾ ਪੁੰਜ 12g ਹੈ ਤਾਂ ਕਾਰਬਨ ਦੇ ਇੱਕ ਪਰਮਾਣੂ ਦਾ ਪੁੰਜ ਕੀ ਹੋਵੇਗਾ ?
ਹੱਲ :
1 ਮੋਲ ਕਾਰਬਨ ਪਰਮਾਣੁ = 6.023 × 1023 ਪਰਮਾਣੂ
6.023 × 1023 ਕਾਰਬਨ ਪਰਮਾਣੂਆਂ ਦਾ ਪੁੰਜ = 12g
∴ 1 ਕਾਰਬਨ ਪਰਮਾਣੁ ਦਾ ਪੰਜ = \(\frac{12}{6.023 \times 10^{23}}\) g
= 1.99 × 10-23 g
ਪ੍ਰਸ਼ਨ 14.
ਕਿਸ ਵਿੱਚ ਵਧੇਰੇ ਪਰਮਾਣੂ ਹੋਣਗੇ : 100g ਸੋਡੀਅਮ ਜਾਂ 100g ਲੋਹਾ ? (Na ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ = 23u, Fe ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ = 56u
ਹੱਲ : 23 ਗ੍ਰਾਮ ਪਰਮਾਣੂ ਇਕਾਈ ਜਾਂ 23g ਸੋਡੀਅਮ (Na) = 1 ਮੋਲ ਸੋਡੀਅਮ
= 6.03 × 1023 ਪਰਮਾਣੁ ਸੋਡੀਅਮ
∴ 100g ਸੋਡੀਅਮ (Na) = \(\frac{6.03 \times 10^{23}}{23}\) × 100
= 2.617 × 1024 ਪਰਮਾਣੂ ……………….. (1)
ਹੁਣ, 56 ਗ੍ਰਾਮ ਪਰਮਾਣੂ ਲੋਹਾ (Fe) ਜਾਂ 56g ਲੋਹਾ = 1 ਮੋਲ ਲੋਹਾ (Fe)
= 6.03 × 1023 ਪਰਮਾਣੂ ਲੋਹਾ
∴ 100g ਲੋਹਾ = \(\) × 100
= 1.075 × 1024 ਪਰਮਾਣੂ ………………. (2)
ਸਮੀਕਰਨ (1) ਅਤੇ (2) ਦੀ ਤੁਲਨਾ ਕਰਨ ਤੇ,
100g ਸੋਡੀਅਮ ਵਿੱਚ 100g ਲੋਹੇ ਨਾਲੋਂ ਵਧੇਰੇ ਪਰਮਾਣੂ ਹਨ ।