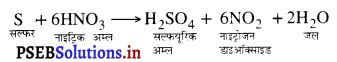Punjab State Board PSEB 8th Class Science Book Solutions Chapter 4 पदार्थ : धातु और अधातु Textbook Exercise Questions and Answers.
PSEB Solutions for Class 8 Science Chapter 4 पदार्थ : धातु और अधातु
PSEB 8th Class Science Guide पदार्थ : धातु और अधातु Textbook Questions and Answers
अभ्यास
प्रश्न 1.
निम्नलिखित में से किसको पीटकर पतली चादरों में परिवर्तित किया जा सकता है ?
(क) जिंक
(ख) फॉस्फोरस
(ग) सल्फर
(घ) ऑक्सीजन।
उत्तर-
(क) जिंक।
प्रश्न 2.
निम्नलिखित में से कौन-सा कथन सही है ?
(क) सभी धातुएँ तन्य होती हैं।
(ख) सभी अधातुएँ तन्य होती हैं।
(ग) सामान्यतः धातुएँ तन्य होती हैं।
(घ) कुछ अधातुएँ तन्य होती हैं।
उत्तर-
(क) सभी धातुएँ तन्य होती हैं।
प्रश्न 3.
रिक्त स्थानों की पूर्ति कीजिए-
(क) फास्फोरस बहुत …………………………. अधातु हैं।
(ख) धातुएँ उष्मा और ………………………… की ……………………. होती है।
(ग) आयरन, कॉपर की अपेक्षा ………………………. अभिक्रियाशील है।
(घ) धातुएँ अम्लों से अभिक्रिया कर ………………………… गैस बनाती हैं।
उत्तर-
(क) क्रियाशील
(ख) विद्युत्, सुचालक
(ग) अधिक
(घ) हाइड्रोजन ।
प्रश्न 4.
यदि कथन सही है तो “T” और यदि गलत है तो कोष्ठक में “F” लिखिए-
(क) सामान्यतः अधातु अम्लों से अभिक्रिया करते हैं।
(ख) सोडियम बहुत अभिक्रियाशील धातु है।
(ग) कॉपर, जिंक सल्फेट के विलयन से जिंक विस्थापित करता है।
(घ) कोयले को खींचकर तारें प्राप्त की जा सकती हैं।
उत्तर-
(क) (True)
(ख) (True)
(ग) (False)
(घ) (False)।
![]()
प्रश्न 5.
नीचे दी गई सारणी में गुणों की सूची दी गई है। इन गुणों के आधार पर धातुओं और अधातुओं में अंतर कीजिए-
| गुण | धातु | अधातु |
| 1. दिखावट | ||
| 2. कठोरता | ||
| 3. आघातवर्धनीयता | ||
| 4. तन्यता | ||
| 5. ऊष्मा चालन | ||
| 6. विद्युत् चालन। |
उत्तर-
धातुओं और अधातुओं में अंतर-
| गुण | धातु | अधातु |
| 1. दिखावट | चमकीली | विभिन्न रंगों |
| 2. कठोरता | कक्ष ताप पर ठोस और कठोर | कक्ष ताप पर ठोस, तरल, गैस और भुरभुरी। |
| 3. आघातवर्धनीयता | पीटकर शीटें बनाई जा सकती हैं | संभव नहीं |
| 4. तन्यता | खींच कर तार बनाई जा सकती है। | अतन्य होती हैं |
| 5. ऊष्मा चालन | उपस्थित | अनुपस्थित |
| 6. विद्युत् चालन। | संभव है। | असंभव है। |
प्रश्न 6.
निम्नलिखित के लिए कारण दीजिए-
(क) ऐलुमिनियम की पन्नी का उपयोग खाद्य सामग्री के लपेटने में किया जाता है।
(ख) निमज्जन छड़ें (इमरशन रॉड) धात्विक पदार्थों से निर्मित होती है।
(ग) कॉपर, जिंक को उसके लवण के विलयन से विस्थापित नहीं कर सकता।
(घ) सोडियम और पोटैशियम को मिट्टी के तेल में रखा जाता है।
उत्तर-
(क) ऐलुमिनियम आघातवर्धक है और वायु, पानी के साथ सक्रिय नहीं है। इसलिए ऐलुमिनियम की पन्नी का उपयोग खाद्य सामग्री को लपेटने के लिए किया जाता है।
(ख) धातुएँ ऊष्मा और विद्युत् की सुचालक होती हैं, इसलिए निमज्जन छड़ें धातुओं की बनाई जाती हैं।
(ग) कॉपर, जिंक से कम सक्रिय होने के कारण, उसे विस्थापित नहीं कर पाता।
(घ) सोडियम और पोटैशियम वायु और जल से शीघ्र क्रिया करते हैं, इसलिए मिट्टी के तेल में रखे जाते हैं।
प्रश्न 7.
क्या आप नींबू के अचार को ऐलुमिनियम के पात्रों में रख सकते हैं ? स्पष्ट करिए।
उत्तर-
नहीं। नींबू का अचार अम्लीय प्रकृति का होता है। अम्लीय पदार्थ ऐलुमिनियम पात्रों में संचित नहीं किए जाते, क्योंकि अम्ल और ऐलुमिनियम अभिक्रिया करके विषैले पदार्थ बनाते हैं, जो खाद्य विषक्तता वाले और स्वास्थ्य विरोधी होते हैं।
प्रश्न 8.
नीचे दी गई सारणी के कॉलम I में कुछ पदार्थ दिये गये हैं। कॉलम II में उनके कुछ उपयोग दिये गये हैं। कॉलम I के पदार्थ का कॉलम II से सही मिलान करिए-
| कॉलम I | कॉलम I |
| 1. गोल्ड | 1. थर्मामीटर |
| 2. आयरन | 2. बिजली के तार |
| 3. ऐलुमिनियम | 3. खाद्य सामग्री लपेटना |
| 4. कार्बन | 4. आभूषण |
| 5. कॉपर | 5. मशीनें |
| 6. मर्करी | 6. ईंधन |
उत्तर-
| कॉलम I | कॉलम I |
| 1. गोल्ड | 4. आभूषण |
| 2. आयरन | 5. मशीनें |
| 3. ऐलुमिनियम | 3. खाद्य सामग्री लपेटना |
| 4. कार्बन | 6. ईंधन |
| 5. कॉपर | 2. बिजली के तार |
| 6. मर्करी | 1. थर्मामीटर |
प्रश्न 9.
क्या होता है जब-
(क) तनु सल्फ्यूरिक अम्ल कॉपर प्लेट पर डाला जाता है।
(ख) लोहे की कील, कॉपर सल्फेट के विलयन में रखी जाती है।
संबंधित अभिक्रियाओं के शब्द समीकरण लिखिए।
उत्तर-
(क) जब तनु सल्फ्यूरिक अम्ल, कॉपर प्लेट पर डाला जाता है, तो हाइड्रोजन गैस उत्पन्न होती है।
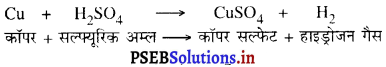
(ख) जब लोहे की कील को कॉपर सल्फेट के विलयन में रखा जाता है, तो लोहा कॉपर को विस्थापित करके आयरन सल्फेट बनाता है।

![]()
प्रश्न 10.
सलोनी ने लकड़ी के कोयले का एक जलता हुआ टुकड़ा लिया और उससे उत्सर्जित होने वाली गैस को एक परखनली में इकट्ठा किया।
(क) वह गैस की प्रकृति कैसे ज्ञात करेगी?
(ख) इस प्रक्रम में होने वाली सभी अभिक्रियाओं के शब्द समीकरण लिखिए।
उत्तर-
(क) गैस की प्रकृति का प्रेक्षण-
- नीले और लाल लिटमस पट्टी से गैस की प्रकृति ज्ञात की जा सकती है। यदि यह नीले लिटमस को लाल कर दे और लाल लिटमस पर कोई प्रभाव न डालें, तो गैस अम्लीय प्रकृति की है।
- जब गैस को पानी में घोला जाता है, तो विलयन नीले लिटमस को लाल कर देता है। यह गैस की अम्लीय प्रकृति का प्रमाण है।
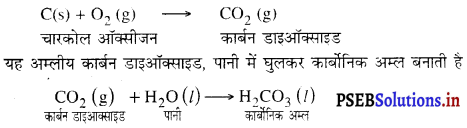
(ख) जब चारकोल को जलाया जाता है, तो यह ऑक्सीजन से अभिक्रिया करके अम्लीय ऑक्साइड, CO2 (कार्बन डाइऑक्साइड) बनाता है।
प्रश्न 11.
एक दिन रीता अपनी मां के साथ आभूषण विक्रेता की दुकान पर गई। उसकी मां ने सुनार को पॉलिश करने हेतु सोने के पुराने आभूषण दिए। अगले दिन जब वे आभूषण वापस लाई तो उन्होंने पाया कि उनका भार कुछ कम हो गया है। क्या आप भार में कमी का कारण बता सकते हैं?
उत्तर-
सुनार आभूषण साफ करने के लिए एक्वारीजिया (Aqua regia) विलयन का उपयोग करते हैं। क्योंकि सोना इस विलयन में घुल जाता है, इसलिए रीता की मां के आभूषण की भार में कमी हो गई।
PSEB Solutions for Class 8 Science पदार्थ : धातु और अधातु Important Questions and Answers
TYPE-I
अति लघु उत्तरात्मक प्रश्न
प्रश्न 1.
धातुओं के उस गुण का नाम लिखो जिससे उन्हें पीट कर चादरें बनाई जा सकती हैं।
उत्तर-
आघातवर्धनीयता।
प्रश्न 2.
तन्यता (Ductility) क्या है ?
उत्तर-
धातु का गुण जिससे इसे खींचकर तार बनाई जा सकती है।
प्रश्न 3.
सबसे अधिक तन्य धातु का नाम लिखिए।
उत्तर-
चांदी (Silver)।
प्रश्न 4.
उस धातु का नाम लिखिए जो द्रव अवस्था में पाई जाती है।
उत्तर-
पारा (Mercury)।
प्रश्न 5.
उस धातु का नाम लिखो जो विद्युत् की कुचालक है।
उत्तर-
सीसा (Lead)।
![]()
प्रश्न 6.
थर्मामीटर में कौन-सी वस्तु का उपयोग होता है?
उत्तर-
पारा (Mercury)।
प्रश्न 7.
कौन-सी धातु और अधातु सामान्य ताप पर द्रव होते हैं ?
उत्तर-
धातु – पारा (Mercury) अधातु-ब्रोमीन (Bromine)।
प्रश्न 8.
धातुओं के दो गुण लिखिए।
उत्तर-
- आघातवर्धनीयता और
- तन्यता।
प्रश्न 9.
दो धातुओं के नाम लिखो जो विद्युत् और ऊष्मा दोनों की सुचालक है।
उत्तर-
ताँबा और ऐलुमिनियम ऊष्मा और विद्युत् दोनों के सुचालक है।
प्रश्न 10.
तीन धातुओं के नाम लिखो जो स्वतंत्र रूप में पाई जाती है।
उत्तर-
- चांदी
- सोना
- प्लेटिनम स्वतंत्र रूप में पाई जाती हैं।
प्रश्न 11.
दो धातुओं के नाम लिखो जो आसानी से काटी जा सकती हैं ?
उत्तर-
- सोडियम और
- पोटाशियम।।
प्रश्न 12.
कौन-से गुण के कारण, धातुओं की तारें खींची जा सकती हैं ?
उत्तर-
तन्यता।
![]()
प्रश्न 13.
किन धातुओं से विद्युत् तारें बनाई जाती हैं ?
उत्तर-
कॉपर (ताँबा) और ऐलुमिनियम।
प्रश्न 14.
हिमोग्लोबिन (Haemoglobin) में कौन-सी धातु घटक है?
उत्तर-
लोहा।
प्रश्न 15.
लोहा (आयरन) और ऑक्सीजन की रासायनिक अभिक्रिया का समीकरण लिखो।
उत्तर-

प्रश्न 16.
जिंक की ऑक्सीजन के साथ रासायनिक अभिक्रिया का समीकरण लिखिए।
उत्तर-

प्रश्न 17.
चांदी, कॉपर, सीसा, आयरन, जिंक, मैग्नीशियम और सोडियम।
(क) ऊपरलिखित में कौन-सी धातु मिट्टी के तेल (Kerosene) में रखी जाती है?
(ख) कौन-सी धातु ठंडे पानी में अभिक्रिया करती है?
(ग) जब धातुएँ ठंडे पानी से अभिक्रिया करती हैं, तो कौन-सी गैसें उत्पन्न होती हैं?
(घ) कौन-सी धातु गर्म करने पर ऑक्सीजन के साथ अभिक्रिया करती है ?
(ङ) कौन-सी धातु हाइड्रोजन सल्फाइड (H,S) की उपस्थिति में काली पड़ जाती है?
(च) कौन-सी धातु ऑक्सीजन में चमकती ज्वाला द्वारा जलती है?
उत्तर-
(क) सोडियम
(ख) सोडियम और मैग्नीशियम
(ग) हाइड्रोजन
(घ) मैग्नीशियम
(ङ) चांदी (Silver)
(च) मैग्नीशियम।
प्रश्न 18.
किन्हीं पांच धातुओं के नाम लिखिए, जिनका उपयोग दैनिक जीवन में होता है।
उत्तर-
दैनिक जीवन में उपयोग होने वाली धातएँ-
- ऐलुमिनियम
- आयरन
- कॉपर
- जिंक
- टिन (कलई)।
![]()
प्रश्न 19.
किन्हीं पांच धातुओं के नाम लिखिए, जिनका उपयोग उद्योग में किया जाता है ?
उत्तर-
उद्योग में उपयोग होने वाली धातुएँ-
- ऐलुमिनियम
- आयरन
- कॉपर
- निकल
- जिंक।
प्रश्न 20.
सोडियम, जिंक, मैग्नीशियम और ऐलुमिनियम स्वतंत्र रूप में क्यों नहीं पाए जाते ?
उत्तर-
क्योंकि यह वायु, पानी और अम्लों के साथ सक्रिय है।
प्रश्न 21.
किन्हीं दो धातुओं का नाम लिखो जो वायु, पानी और अम्लों से सक्रिय नहीं हैं ?
उत्तर-
- सोना और
- प्लेटिनम।
प्रश्न 22.
किस गुण कारण धातुएँ आभूषणों में उपयोगी होती हैं?
उत्तर-
धात्विक चमक।
प्रश्न 23.
कॉपर धातु का रंग क्या है ?
उत्तर-
भूरा-लाल।
प्रश्न 24.
आयरन, कॉपर और मैग्नीशियम में से कौन-सी धातु आसानी से काटी जा सकती है?
उत्तर-
मैग्नीशियम।
TYPE-II
लघु उत्तरात्मक प्रश्न
प्रश्न 1.
धातु और अधातु में क्या अंतर है ? प्रकृति में कितने तत्त्व पाए जाते हैं ?
उत्तर-
धातुओं में धात्विक चमक, आघातवर्धनीयता, तन्यता, ऊष्मा और विद्युत् की चालकता, कठोरता और ऑक्सीजन के साथ क्षारीय ऑक्साइड बनाने के गुण होते हैं।
अधातुएँ निष्प्रभ होती हैं, ये न तो आघातवर्धनीय और न ही तन्य होती हैं। ये ऊष्मा और विद्युत् की कुचालक होती हैं। ये कम कठोर और भुरभुरी होती हैं। ऑक्सीजन के साथ अम्लीय ऑक्साइड बनाने की क्षमता रखती हैं।
प्रकृति में 92 तत्त्व पाए जाते हैं।
प्रश्न 2.
पोटाशियम तत्त्व को पानी में क्यों नहीं रखा जाता?
उत्तर-
पोटाशियम एक सक्रिय तत्त्व है। यह कक्ष के तापमान पर ही वायु से अभिक्रिया कर सकता है और पानी के साथ अभिक्रिया करके आग पकड़ लेता है।
अतः इसे मिट्टी के तेल में रखा जाता है, पानी में नहीं।

प्रश्न 3.
उन दो गुणों के बारे में लिखो जो धातुओं को अधातुओं से भिन्न करते हैं।
उत्तर-
- धातुएँ ऊष्मा और विद्युत् की सुचालक हैं जबकि अधातुएँ ऊष्मा और विद्युत् की कुचालक हैं।
- धातुओं में धात्विक चमक होती है अर्थात् इनकी सतह चमकीली होती है जब कि अधातुएँ निष्प्रभ होती हैं। यह प्रकाश का परावर्तित नहीं करती।
![]()
प्रश्न 4.
एक रासायनिक गुण लिखिए जिससे धातु और अधातु में अंतर किया जा सकता है?
उत्तर-
धातुएँ जब जलती हैं, तो ऑक्सीजन के साथ अभिक्रिया करके क्षारीय ऑक्साइड बनाती हैं जबकि अधातुएँ अम्लीय ऑक्साइड बनाती हैं। इस गुण के आधार पर धातुओं और अधातुओं को पृथक् किया जा सकता है।
प्रश्न 5.
सोडियम को मिट्टी के तेल में क्यों रखा जाता है?
उत्तर-
(घ) सोडियम और पोटैशियम वायु और जल से शीघ्र क्रिया करते हैं, इसलिए मिट्टी के तेल में रखे जाते हैं।
प्रश्न 6.
निम्न का वर्णन करें-
(क) अम्लीय ऑक्साइड
(ख) क्षारीय ऑक्साइड।
उत्तर-
(क) अम्लीय ऑक्साइड – यह अधातु का ऑक्साइड है और पानी में घुलकर अम्ल बनाता है।
उदाहरण – CO2 SO2 आदि।
(ख) क्षारीय ऑक्साइड – यह धातु का ऑक्साइड और पानी में घुलकर क्षारीय विलयन देता है।
उदाहरण – सोडियम ऑक्साइड, कैल्शियम ऑक्साइड आदि।
प्रश्न 7.
धातुओं की प्रकृति में उपलब्धता का वर्णन करें।
उत्तर-
प्रकृति में धातुओं की उपलब्धता – धातु प्रकृति में स्वतंत्र और यौगिक रूप में पाए जाते हैं।
(क) स्वतंत्र रूप – धातुएँ जो वायु और नमी से प्रभावित नहीं होतीं, प्रकृति में स्वतंत्र रूप में पाई जाती हैं, जैसेसोना, प्लेटिनम।
(ख) यौगिक रूप – धातुएँ प्रायः ऑक्साइड तथा सल्फाइड के यौगिकों के रूप में पाई जाती हैं। ये धातुएँ यौगिक रूप में होती हैं, जैसे-ऐलुमिनियम ऑक्साइड।
प्रश्न 8.
धातु की आघातवर्धनीयता और तन्यता से क्या अभिप्राय है ? दो धातुओं के उदाहरण दीजिए जो तन्य और आघातवर्धक दोनों हैं।
उत्तर-
तन्यता – यह धातुओं का गुण है, जिससे उन्हें खींचकर पतली लंबी तारें बनाई जा सकती हैं। जो धातुएँ यह गुण दर्शाती हैं, तन्य कहलाती हैं।
उदाहरण – कॉपर, ऐलुमिनियम, चांदी, सोना।
आघातवर्धनीयता – धातुओं का वह गुण जिसमें धातुओं को पीटकर चादरों में बदला जा सकता है, बिना टूटे मोड़ा (rwist) जा सकता है, आघातवर्धनीयता कहलाती है।
उदाहरण – सोना, चांदी, ऐलुमिनियम। धातुएँ जो दोनों आघातवर्धनीय और तन्य हैं-ऐलुमिनियम और सोना।
प्रश्न 9.
चांदी ऑक्सीजन के साथ आसानी से अभिक्रिया नहीं करती, परंतु चांदी के आभूषण कुछ समय बाद काले हो जाते हैं। कैसे?
उत्तर-
चांदी, ऑक्सीजन के साथ आसानी से अभिक्रिया नहीं करती, परंतु यह वायु में उपस्थित सल्फर यौगिकों से अभिक्रिया करके सिल्वर सल्फाइड की काली पर्त बनाती है। इसलिए चांदी के आभूषण कुछ समय के पश्चात् काले पड़ जाते हैं।
प्रश्न 10.
सोने के आभूषण वर्षों के उपयोग के बाद भी नए क्यों नज़र आते हैं ?
उत्तर-
सोना अभिक्रियाशील नहीं है। इसलिए सोने को जंग नहीं लगता है और न ही यह काला पड़ता है। इसलिए वर्षों के उपयोग के बाद भी सोने के आभूषण नए नज़र आते हैं।
![]()
प्रश्न 11.
मैग्नीशियम और कॉपर सीधे ज्वाला पर गर्म किए जाते हैं। इनमें कौन-सा वायु में जलेगा? कौनसा अधिक अभिक्रियाशील है ?
उत्तर-
जब मैग्नीशियम और कॉपर सीधे ज्वाला पर गर्म करेंगे तो मैग्नीशियम जल उठेगा। मैग्नीशियम अधिक अभिक्रियाशील है।
प्रश्न 12.
CuSO4 + Fe → FeSO4 + Cu
FeSO4 + Zn → ZnSO4 + Fe
उपरोक्त अभिक्रियाओं के आधार पर बताइए कि जिंक, कॉपर और लोहे में से कौन-सी धातु अधिक अभिक्रियाशील है और कौन-सी कम ?
उत्तर-
पहली अभिक्रिया में लोहे ने कॉपर को विस्थापित किया और इसलिए आयरन (लोहा), कापर की अपेक्षा अधिक अभिक्रियाशील है। दूसरी अभिक्रिया में ज़िंक ने आयरन का विस्थापित किया, इसलिए जिंक, आयरन की अपेक्षा से अधिक अभिक्रियाशील है। इन दोनों रासायनिक समीकरणों को देखने से यह पता चलता है कि जिंक सबसे अधिक अभिक्रियाशील और कॉपर सबसे कम अभिक्रियाशील धातु है।
प्रश्न 13.
जब जिंक की एक छड़ कॉपर सल्फेट के विलयन में डाली जाए, तो क्या होगा?
उत्तर-
ज़िंक, कॉपर की अपेक्षा अधिक अभिक्रियाशील होने के कारण कॉपर को उसके लवणीय विलयन में से विस्थापित करता है।
Zn + CuSO4 → ZnSO4 + Cu
प्रश्न 14.
अचार, चटनी और खट्टे (Citrus) फल लोहे और ऐलुमिनियम के बर्तनों में क्यों नहीं रखे जाते?
उत्तर-
कुछ खाद्य पदार्थ जैसे कि खट्टे फल (Citrus fruit), आचार, चटनी, दही, जिनमें अम्ल होता है जो लोहे और ऐलुमिनियम से बने पात्रों से अभिक्रिया करके विषैले पदार्थ बनाता है। इसलिए लोहे और ऐलुमिनियम के पात्र अचार, चटनी आदि के लिए उपयोग में नहीं लाए जाते हैं।
प्रश्न 15.
क्या कापर आयरन सल्फेट विलयन से आयरन विस्थापित कर सकता है ? कारण बताओ।
उत्तर-
नहीं, क्योंकि कॉपर आयरन से कम अभिक्रियाशील है। इसलिए यह आयरन को इसके विलयन (आयरन सल्फेट) से विस्थापित नहीं कर सकता। केवल अधिक अभिक्रियाशील धातुएँ कम अभिक्रियाशील धातुओं का विस्थापन कर सकती हैं। इसका उल्ट संभव नहीं है अर्थात् कम अभिक्रियाशील धातुएँ अधिक अभिक्रियाशील धातुओं का विस्थापन नहीं कर सकतीं।
प्रश्न 16.
ऐलुमिनियम के बर्तन कुछ समय पश्चात् अपनी चमक क्यों खो देते है ?
उत्तर-
ऐलुमिनियम एक क्रियाशील धातु है। समय के साथ ऊपरी सतह वायु तथा जल के संपर्क में आकर ऐलुमिनियम आक्साइड की परत बनाती है। इस तरह यह अपनी चमक खो बैठती है।
प्रश्न 17.
खाना बनाने वाले बर्तन तैयार करने के लिए कॉपर की जगह ऐलुमिनियम को क्यों प्राथमिकता दी
जाती है ? कारण दीजिए।
उत्तर-
निम्नलिखित दो कारणों से खाना बनाने वाले बर्तन तैयार करने के लिए कॉपर के स्थान पर ऐलुमिनियम को प्राथमिकता दी जाती है :
- यह बहुत हल्की तथा उष्मा की सुचालक धातु है।
- खाद्य पदार्थ में उपस्थित अम्ल इसके साथ शीघ्र क्रिया नहीं करते हैं।
प्रश्न 18.
क्षरण किसे कहते हैं ? धातुओं के क्षरण को कम करने के लिए क्या उपाय हैं ?
उत्तर-
क्षरण – धातुओं को जब आर्द्र वायु में खुला छोड़ा जाता है तो इन पर एक बिना चमक वाली परत जम जाती है। यह परत शीघ्र हट जाती है और नीचे अगली परत क्रिया के लिए प्राप्त हो जाती है। इस प्रकार धातु का क्षरण होता रहता है।
क्षरण को कम करने के उपाय-
- धातु की सतह पर पेंट पोत कर ।
- धातु की सतह पर ग्रीज़ अथवा तेल चिपका कर।
- धातु पर किसी अन्य क्रियाशील धातु की परत जमा करके
- मिश्रधातु बनाकर।
![]()
प्रश्न 19.
सोडियम संयुक्त अवस्था में मिलती है जबकि सोना मुक्त अवस्था में मिलता है। क्यों ?
उत्तर-
सोडियम सबसे अधिक क्रियाशील धातु है। यह शीघ्र ही वायु तथा जल से क्रिया करके अपना यौगिक बना लेती है। इसलिए यह यौगिक के रूप में मिलती है। दूसरी भोर सोना, वायु, जल से क्रिया नहीं करता है जिससे वह मुक्त अवस्था में पाया जाता है।
प्रश्न 20.
क्या कॉपर को जंग लगता है ? क्या होगा यदि कॉपर को आर्द्र वायु के संपर्क में रखा जाए?
उत्तर-
कॉपर (ताँबे) को जंग नहीं लगता है। जब कॉपर को आर्द्र वायु में लंबे समय के लिए रखा जाता है तो इस पर बिना चमक वाली एक परत जम जाती है। इस प्रकार बना पदार्थ कॉपर हाइड्रोक्साइड Cu(OH)2 तथा कॉपर कार्बोनेट [CuCO3] का मिश्रण है। निम्नलिखित अभिक्रिया होती है :
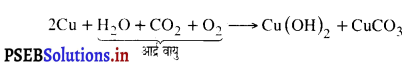
प्रश्न 21.
निम्नलिखित के कारण बताओ-
(i) ऐलुमिनियम धातु वायुयानों के भाग बनाने में प्रयोग किए जाते हैं।
(ii) कॉपर धातु विद्युत् वाहक तारें बनाने में प्रयुक्त की जाती है।
(iii) दर्पण बनाने के लिए चांदी प्रयोग की जाती है।
(iv) ग्रेफाइट, सूखे सेल में इलेक्ट्रोड के रूप में प्रयोग किया जाता है।
(v) पुल तथा डैम बनाने में लोहा प्रयोग किया जाता है।
उत्तर-
(i) क्योंकि ऐलुमिनियम हल्की तथा मज़बूत धातु है, इसलिए वायुयानों के भाग बनाने में प्रयोग की जाती है।
(ii) कॉपर, विद्युत् की सुचालक होने के कारण विद्युत् तारें बनाने के लिए प्रयोग में लायी जाती है।
(iii) चाँदी एक चमकदार सफेद धातु है और इसकी परावर्तन शक्ति भी उच्च है। इसलिए इसे दर्पण बनाने के लिए इस्तेमाल किया जाता है।
(iv) ग्रेफाइट विद्युत का सुचालक होने के कारण सेल में इलेक्ट्रोड के रूप में प्रयोग किया जाता है।
(v) क्योंकि लोहा एक मजबूत धातु है, इसलिए इसे पुल तथा डैम के निर्माण में प्रयोग किया जाता है।
TYPE-III
दीर्घ उत्तरात्मक प्रश्न
प्रश्न 1.
धातुओं की सामान्य भौतिक विशेषताएँ लिखो।
उत्तर-
धातुओं की सामान्य भौतिक विशेषताएँ-
- इनकी चमकीली सतह होती है अर्थात् इनमें धात्विक चमक होती है।
- ये प्रायः कठोर होती हैं। विभिन्न धातुओं की कठोरता भिन्न-भिन्न होती है।
- प्रायः धातुएँ आघातवर्धक होती हैं अर्थात् इनको पीटकर चादरें बनाई जा सकती हैं।
- प्रायः धातुएँ तन्य होती हैं अर्थात् इनको खींचकर लंबी तारें बनाई जा सकती हैं।
- धातुएँ ऊष्मा और विद्युत् की सुचालक होती हैं। सोना, चांदी, कापर और ऐलुमिनियम में से विद्युत् प्रवाह आसानी से हो सकता है।
- धातुओं में प्रायः धात्विक ध्वनि होती है अर्थात् टकराने पर आवाज़ पैदा करती हैं।
- पारे के अतिरिक्त अन्य सभी धातुएँ ठोस अवस्था में पाई जाती हैं।
- धातुओं के उच्च गलनांक होते हैं।
प्रश्न 2.
अधातुओं की सामान्य भौतिक विशेषताएँ लिखिए।
उत्तर-
अधातुओं की सामान्य भौतिक विशेषताएँ-
- चमक – अधातुओं की चमक नहीं होती अर्थात् यह प्रकाश का परावर्तन नहीं करती। ग्रेफाइट और हीरे अपवाद हैं।
- चालकता – ग्रेफाइट के अतिरिक्त अन्य सभी अधातुएँ ऊष्मा और विद्युत् की कुचालक होती हैं।
- अवस्था – अधातुएँ ठोस, द्रव और गैस रूप में पाई जाती हैं। उदाहरण के लिए सल्फर, कार्बन और आयोडीन ठोस हैं। ब्रोमीन द्रव है। क्लोरीन और नाइट्रोजन गैस है।
- आघातवर्धयता तथा तन्यता – अधातुएँ आघातवर्धक नहीं होती हैं। ये भुरभुरी होती हैं। अधातुएँ पीटने पर छोटे-छोटे टुकड़ों में बिखर जाती हैं।
- कठोरता – हीरे को छोड़कर अन्य सभी अधातुएं सामान्यतः अधिक कठोर नहीं होती हैं। हीरा सबसे अधिक कठोर पदार्थ है।
- तन्यता – अधातुओं की तारें नहीं खींची जा सकतीं इसलिए ये तन्य नहीं हैं।
- गलनाक तथा क्वथनांक – अधातुओं के गलनांक और क्वथनांक कम होते हैं। अधिकतर अधातुएँ गैसें हैं। केवल ग्रेफाइट का गलनांक अधिक होता है।
प्रश्न 3.
धातुएँ अम्लों के साथ कैसे क्रिया करती हैं ?
उत्तर-
धातुओं की अम्लों के साथ क्रिया-
(क) जिंक, मैग्नीशियम, लोहे आदि जैसी सक्रिय धातुएँ जो अभिक्रियाशील शृंखला में हाइड्रोजन से ऊपर स्थित हैं, तनु हाइड्रोक्लोरिक और सल्फ्यूरिक अम्ल जैसे खनिज अम्लों से अभिक्रिया करके हाइड्रोजन का विस्थापन करती हैं।

(ख) वे धातुएँ क्रियाशीलता शृंखला में जो हाइड्रोजन से नीचे स्थित हैं, तनु खनिज अम्लों के साथ हाइड्रोजन का विस्थापन नहीं करतीं।
उदाहरण के लिए – कॉपर धातु, तनु HCl से कोई अभिक्रिया नहीं करती।
![]()
प्रश्न 4.
धातुएँ पानी से कैसे अभिक्रिया करती हैं ?
उत्तर-
धातुओं की पानी से क्रिया – विभिन्न धातुओं की पानी के साथ भिन्न-भिन्न अभिक्रियाशीलता है। सभी धातुएँ विभिन्न परिस्थितियों में पानी के साथ अभिक्रिया कर हाइड्रोजन गैस उत्पन्न करती हैं।
(क) Na, K, जैसी सक्रिय धातुएँ कक्ष ताप पर पानी से अभिक्रिया करती हैं।

यह क्रिया अत्यधिक तीव्र और ऊष्मा पैदा करने वाली है इसलिए हाइड्रोजन आग पकड़ लेती है।
(ख) कम सक्रिय धातुएँ जैसे-Mg, Zn, Al उबलते पानी से अभिक्रिया करती हैं।

(ग) गर्म धातु जैसे Fe भाप से धीरे-धीरे अभिक्रिया करती है।

प्रश्न 5.
निम्न में से कौन-सी विस्थापन अभिक्रिया संभव नहीं है ?
(क) CuSO4(aq) + Fe → Fe SO4(aq) + Cu
(ख) FeSO4(aq) + Zn → Zn SO4(aq) + Fe
(ग) ZnSO4(aq) + Pb → Pb SO4(aq) + Zn
(घ) 2AgNO3(aq) + Cu → Cu NO3(aq) + 2Ag
(ङ) MgSOA4(aq) + Cu → Cu SO4(aq) + Mg
उत्तर-
केवल एक सक्रिय धातु (अभिक्रिया श्रृंखला में ऊपर स्थित धातु) ही कम अभिक्रियाशील धातु का विस्थापन कर सकती है।
उपरोक्त अभिक्रियाओं में से
(ग) और
(ङ) संभव नहीं
क्योंकि जिंक लैड से और मैग्नीशियम कॉपर से अधिक सक्रिय है।
प्रश्न 6.
दैनिक जीवन में प्रयोग की जाने वाली तीन धातुओं के नाम तथा उनके उपयोग लिखो।
उत्तर-
हम प्रत्यक्ष या अप्रत्यक्ष रूप से निम्नलिखित तीन धातुएँ दैनिक जीवन में प्रयोग करते हैं-
(1) लोहा
(2) कॉपर
(3) ऐलुमिनियम।
(1) लोहे के उपयोग-
- लोहे को अन्य धातुएं से मिश्रित करके अधिकतर रेलगाड़ियाँ, वाहन तथा अन्य मशीनों के पुर्जे बनाये जाते हैं।
- लोहे को सीमेंट से मिलाकर बड़ी इमारतें तथा डैम बनाये जाते हैं।
- लोहे को उद्योग के लिए बॉयलर तथा पुल बनाने के लिए प्रयोग किया जाता है।
(2) कॉपर (ताँबे) के उपयोग-
- यह खाना पकाने वाले बर्तन बनाने में प्रयोग की जाती है।
- यह फोटो-फ्रेम, सिक्के तथा, बुत बनाने के लिए प्रयोग की जाती है।
- यह विद्युत वाहक तारें बनाने के लिए प्रयोग की जाती है।
(3) ऐलुमिनियम के उपयोग-
- यह हवाई जहाज़ बनाने के लिए प्रयोग की जाती है।
- यह विद्युत् सचित्रों तथा विद्युत् की तारें बनाने में इस्तेमाल की जाती है।
- ऐलूमिनियम के पत्र (वर्क) वस्तुओं को पैक करने के लिए प्रयोग की जाती है।
प्रश्न 7.
रासायनिक गुणों के आधार पर धातुओं तथा अधातुओं में अंतर स्पष्ट करो।
उत्तर-
रासायनिक गुणों के आधार पर धातुओं तथा अधातुओं में अंतर-
| धातु | अधातु |
| (1) आयनों की प्रकृति – धातु विद्युतीय धनात्मक तत्त्व हैं और इलैक्ट्रॉन खोकर धन आयन बनाते हैं। | (1) अधातुएँ विद्युतीय ऋणात्मक तत्त्व हैं तथा इलैक्ट्रॉन प्राप्त करके ऋण आयन बनाती हैं। |
| (2) ऑक्साइडों की प्रकृति – ये क्षारीय ऑक्साइड बनाती हैं। | (2) अधातुएं अम्लीय आक्साइड बनाते हैं। |
| (3) जल से क्रिया – अधिकांश धातुएँ हाइड्रोजन विस्थापित करती हैं। | (3) अधातुएँ, जल से अभिक्रिया नहीं करती हैं। |
| (4) अम्लों के साथ क्रिया – क्रियाशील शृंखला में हाइड्रोजन से ऊपर स्थित धातुएँ अम्लों से हाइड्रोजन विस्थापित करती हैं। | (4) अधातुएँ तनु अम्लों से क्रिया नहीं करती हैं। |
| (5) हाइड्राइडों की प्रकृति – धातुएँ, हाइड्रोजन के साथ क्रिया करके आयनिक हाइड्राइड बनाती हैं। | (5) ये सह-संयोजी हाइड्राइड बनाती हैं। |
| (6) कलोराइड की प्रकृति – धातुएँ कलोरीन के साथ क्रिया करके ठोस आयनिक कलोराइड बनाती हैं जिनमें से विद्युत् का संचरण होता है। | (6) अधातुएँ कलोरीन के संयोजन से सह-संयोजी कलोराइड बनाती हैं जो विद्युत् हैं जो विद्युत् का संचार नहीं करती। |
![]()
प्रश्न 8.
अधातुएँ के सामान्य रासायनिक गुण लिखिए।
उत्तर-
(i) वायु या आक्सीजन से अभिक्रिया – अधातुएँ, वायु या ऑक्सीजन के साथ अभिक्रिया करके अपने ऑक्साइड बनाती हैं जोकि प्रकृति में अम्लीय हैं। ये ऑक्साइड नीले लिटमस को लाल करते हैं।

(ii) हाइड्रोजन के साथ क्रिया – अधातुएँ जैसे कार्बन, नाइट्रोजन तथा फास्फोरस आदि हाइड्रोजन के साथ क्रिया करके विभिन्न यौगिक बनाती हैं।

(iii) अन्य अधातुओं से अभिक्रिया – अधातुएँ दूसरी अधातुओं के साथ क्रिया करके विभिन्न यौगिक बनाती हैं।

(iv) अम्लों के साथ अभिक्रिया – अधातुएँ, अम्लों के साथ क्रिया करके ऑक्सी-अम्ल बनाती हैं।