Punjab State Board PSEB 10th Class Science Important Questions Chapter 2 अम्ल, क्षारक एवं लवण Important Questions, and Answers.
PSEB 10th Class Science Important Questions Chapter 2 अम्ल, क्षारक एवं लवण
दीर्घ उत्तरात्मक प्रश्न (Long Answer Type Questions)
प्रश्न 1.
उदासीनीकरण क्रिया से क्या अभिप्राय है? इसे प्रयोग द्वारा समझाइए।
उत्तर-
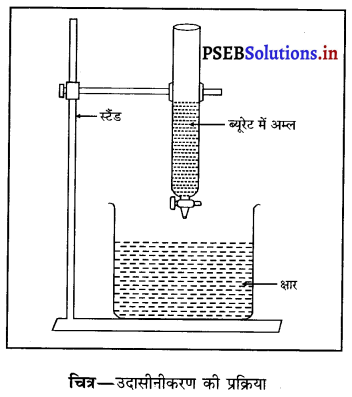
उदासीनीकरण-ऐसी रासायनिक क्रिया जिसमें अम्ल, क्षारकों के साथ मिलकर उन्हें उदासीन कर दें तथा लवण और पानी बना दें, उसे उदासीनीकरण क्रिया कहते हैं। – प्रयोग-एक बीकर में थोड़ा-सा तनु सोडियम हाइड्रोक्साइड का घोल लीजिए। उसमें कुछ बूंदें फिनालफ्थेलीन घोल की डालो।
इसका रंग गुलाबी हो जाएगा। अब एक ब्यूरेट में तनु हाइड्रोक्लोरिक अम्ल (HCl) भरकर उसे चित्र अनुसार ऊर्ध्वाकर स्टैंड में फिट करो तथा बीकर को उसके नीचे रखो। अब ब्यूरेट की सहायता से धीरे-धीरे हाइड्रोक्लोरिक अम्ल बीकर में डालते जाओ और बीकर को हिलाते जाओ। जब घोल का रंग समाप्त हो जाए तो उसमें अम्ल डालना बंद कर दो। अब इस घोल पर नीले और लाल लिटमस का कोई प्रभाव नहीं पड़ता। अतः अब बीकर में केवल लवण व पानी है जो लिटमस के प्रति उदासीन है। इस क्रिया को उदासीनीकरण क्रिया कहते हैं।
प्रश्न 2.
अम्लों के रासायनिक गुण संक्षेप में लिखिए।
उत्तर-
अम्लों के अनेक रासायनिक गुण हैं-
(i) धातुओं से क्रिया-अम्ल सक्रिय धातुओं से क्रिया करते हैं। जिंक मैग्नीशियम लोहा, मैंगनीज़ आदि इनसे क्रिया करके हाइड्रोजन गैस उत्पन्न करते हैं-
Zn (s) + तनु H2SO4 (aq) → ZnSO4 (aq) + H2 (g)
Mg (s) + तनु 2HCl (aq) → MgCl2 (aq) + H2 (g)
(ii) धातु कार्बोनेट और धातु बाइकार्बोनेट से क्रिया-अम्ल धातु कार्बोनेट और धातु बाइकार्बोनेट से क्रिया कर CO2 उत्पन्न करते हैं।
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
NaHCO3 + HCl → NaCl + H2O + CO2
(iii) क्षारकों से क्रिया-अम्ल क्षारकों से क्रिया कर उदासीनीकरण को प्रकट करते हैं। वे लवण तैयार करते हैं।
HCl + NaOH → NaCl + H2O
HCl + KOH → KCl + H2O
(iv) धातु सल्फाइट और बाइसल्फाइट से क्रिया-अम्ल धातु सल्फाइट और धातु बाइसल्फाइट से क्रिया करके SO2 गैस उत्पन्न करते हैं।
CaSO3 + H2SO4 → CasO4 + H2O + SO2 (g)
Na HSO3 + HCl → NaCl + H2O + SO2 (g)
(v) धातु सल्फाइड और हाइड्रोजन सल्फाइड से क्रिया-अम्ल विभिन्न धातु सल्फाइडों तथा हाइड्रोजन सल्फाइड से क्रिया कर H2S गैस उत्पन्न करते हैं।
FeS + H2SO4 → FeSO4 + H2S (g)
KHS + 2HCI — KCl + H2S (g)
(पोटाशियम हाइड्रोजन सल्फाइड)
(vi) धातु क्लोराइडों से क्रिया-जब धातु क्लोराइड को अम्लों के साथ गर्म किया जाता है तो क्रिया होती है।
NaCl + H2SO4 → NaHSO4 + HCl (g)
NaCl + NaHSO4 → Na2SO4 + HCl (g)
(vii) धातु नाइट्रेट से क्रिया-धातु नाइट्रेट से सांद्र अम्ल क्रिया करता है।
NaNO3 + H2SO4 → NaHSO4 + HNO3
NaNO3 + NaHSO4 → Na2SO3 + HNO3
(vii) धातु ऑक्साइड से अम्लों की क्रिया-धातु, ऑक्साइड तनु अम्लों से क्रिया कर धातु के लवण तैयार करते हैं।
Na2O + 2HNO3 → 2NaNO3 + H2O
CuO + 2HCl → CuCl2 + H2O
![]()
प्रश्न 3.
क्षारकों/क्षारों के रासायनिक गुण संक्षेप में लिखिए।
उत्तर-
क्षारकों/क्षारों के महत्त्वपूर्ण रासायनिक गुण निम्नलिखित हैं –
(i) धातुओं से क्रिया-क्षार कुछ धातुओं से क्रिया कर H2 गैस उत्पन्न करते हैं।
Zn + 2NaOH → Na2 ZnO2 + H2 (g) सोडियम जिंकेट
2Al + 2NaOH + 2H2O → 2NaAlO2+ 3H2 सोडियम एलुमिनेट
(ii) वायु से क्रिया-कुछ क्षार वायु में उपस्थित CO2 से क्रिया करते हैं।
2NaOH + CO2 → Na2CO3
2KOH + CO2 → K2CO3
(iii) अम्लों से क्रिया-क्षारक/क्षार अम्लों से क्रिया कर लवण तैयार करते हैं।
NaOH + HCl → NaCl + H2O
Fe(OH)2 + 2HCl → FeCl2+ 2H2O
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
(iv) लवणों से क्रिया-तांबा, लोहा, जिंक आदि के लवण क्षारों/क्षारकों से क्रिया करते हैं और अघुलनशील धात्विक हाइड्रॉक्साइड तैयार करते हैं।
ZnSO4 + 2NaOH → Na2SO4 + Zn(OH)2↓
CuSO4 + 2NH4OH → (NH4)2SO4 + Cu(OH)2↓
FeCl3 + 3NaOH → 3NaCl + Fe(OH)3↓
प्रश्न 4.
दैनिक जीवन में pH का महत्त्व स्पष्ट कीजिए।
उत्तर-
pH का हमारे दैनिक जीवन में बहुत अधिक महत्त्व है।
(i) मानव और जंतु जगत् में हमारे शरीर की अधिकांश क्रियाएं 7.0 से 7.8 pH परास के बीच काम करती हैं। हम इसी संकीर्ण परास में ही जीवित रह सकते हैं। हमारे रक्त, आँसुओं, लार आदि का pH लगभग 7.4 होता है। यदि यह 7.0 से कम हो जाता है या 7.8 से बढ़ जाता है तो जीवन असंभव-सा हो जाता है। वर्षा के जल से pH का मान जब 7 से कम होकर 5.6 हो जाता है तो उसे अम्लीय वर्षा कहते हैं। अम्लीय वर्षा का जल जब नदियों में बहता है तो नदी के जल का pH का मान कम हो जाता है जिस कारण जलीय जीवधारियों का जीवन कठिन हो जाता है।
(ii) पेड़-पौधों के लिए-पेड़-पौधों की अच्छी वृद्धि और अच्छी उपज के लिए मिट्टी के pH परास की विशेषता बनी रहनी चाहिए। यदि यह अधिक अम्लीय या क्षारीय हो जाए तो उपज पर कुप्रभाव पड़ता है।
(iii) पाचन-तंत्र-हमारे पेट में HCl उत्पन्न होता रहता है जो हमें बिना हानि पहुँचाए भोजन के पाचन में सहायक होता है। अपच की स्थिति में इसमें अम्ल की मात्रा अधिक बनने लगती है। जिस कारण पेट में दर्द और जलन अनुभव होता है। इस दर्द से छुटकारा पाने के लिए ऐंटैसिड जैसे क्षारकों का प्रयोग करना पड़ता है। इसके लिए प्रायः मिल्क ऑफ़ मैग्नीशियम जैसे दुर्बल क्षारक का प्रयोग करना आवश्यक हो जाता है।
(iv) दंत-क्षय-हमारे मुँह के pH का मान 5.5 से कम होने पर दांतों का क्षय शुरू हो जाता है। हमारे दांत कैल्सियम फॉस्फेट से बने होते हैं जो शरीर का सबसे कठोर पदार्थ है। यह जल में नहीं घुलता पर मुँह की pH का 5.5 से कम होने पर यह नष्ट होने लगता है। मुँह में उपस्थित जीवाणु, अवशिष्ट शर्करा और खाद्य पदार्थों के निम्नीकरण से अम्ल उत्पन्न होते हैं। इनसे छुटकारा पाने के लिए क्षारकीय दंत-मंजन का प्रयोग किया जाना चाहिए। इससे अम्ल की अधिकता उदासीन हो जाती है और दांत क्षय से रोके जा सकते हैं।
(v) जीव-जंतुओं के डंक से रक्षा-जब जीव जंतु कभी डंक मार देते हैं तो वे हमारे शरीर में विशेष प्रकार के अम्ल छोड़ देते हैं। मधुमक्खी भिरंड, चींटी आदि मेथैनॉइक अम्ल हमारे शरीर में डंक के माध्यम से पहुंचा देते हैं। इससे उत्पन्न पीड़ा से मुक्ति के लिए डंक मारे गए अंग पर बेकिंग सोडा जैसे दुर्बल क्षारक का प्रयोग करना चाहिए।
(vi) विशेष पौधों से रक्षा-नेटल (Nettle) पौधे के पत्तों पर डंकनुमा बाल होते हैं। उन्हें छू जाने से डंक जैसा दर्द होता है। इन बालों से मेथैनॉइक अम्ल का स्राव होता है जो दर्द का कारण बनता है। पारंपरिक तौर पर इस पीड़ा से मुक्ति डॉक पौधे की पत्तियों को डंक वाले स्थान पर रगड़ कर पाई जाती है।
लघु उत्तरात्मक प्रश्न (Short Answer Type Questions)
प्रश्न 1.
सूचक किसे कहते हैं ? सूचकों के किस आधार पर भेद किए जाते हैं ? स्पष्ट कीजिए।
उत्तर-
सूचक-वे पदार्थ जो अम्लीय और क्षारकीय विलयनों में निश्चित रंग परिवर्तन करते हैं उन्हें सूचक कहते हैं।
सूचकों की विशेषताओं और गुणों के आधार पर इनके दो भाग किए जाते हैं –
- अम्लीय और क्षारकीय माध्यमों को रंग देने वाले सूचक
- अम्लीय और क्षारकीय माध्यमों को गंध देने वाले सूचक।
1. रंग देने वाले सूचक-
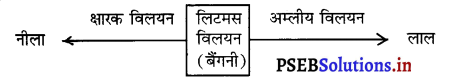
(क) लिटमस विलयन-लिचेन पौधों से प्राप्त किया जाने वाला लिटमस बैंगनी रंग का होता है। यह नीले और लाल रंग में विलयन या पत्र के रूप में मिलता है। नीला लिटमस अम्ल की उपस्थिति को लाल रंग में बदल कर प्रदर्शित करता है और लाल लिटमस क्षारक को नीले रंग में बदलता है। लिटमस स्वयं न तो अम्लीय होता है और न क्षारीय।
(ख) टरमैरिक (हल्दी)-हल्दी का घोल क्षारकों को लाल-भूरे रंग में बदल देता है। इसी के कारण कपड़े पर लगा सब्जी का निशान क्षारकीय साबुन से धोने पर लाल-भूरा हो जाता है।
(ग) फिनॉलफ्थेलिन-यह संश्लिष्ट सूचक है। यह क्षारकों के साथ गुलाबी रंग बनाता है।
(घ) मिथाइल आरेंज-यह भी संश्लिष्ट सूचक है। यह अम्लीय विलयन को गुलाबी रंग में बदलता है और क्षारक को पीले रंग में परिवर्तित करता है।
2. गंधीय सूचक-प्याज़ के कटे हुए छोटे-छोटे टुकड़े वे नीला गंध और लौंग का तेल अम्लों और क्षारकों के साथ भिन्न गंध उत्पन्न कर इनके परीक्षण में सहायक सिद्ध होते हैं।
![]()
प्रश्न 2.
हमारे दैनिक जीवन में अम्लों के चार उपयोग लिखिए।
उत्तर-
- सिरका हमारे भोजन को पकाने और उसकी सुरक्षा तथा आचार बनाने के काम आता है।
- हमारे पेट में HCl हानिकारक जीवाणुओं को नष्ट कर देता है जो भोजन के साथ वहाँ पहुँच जाते हैं।
- टारटेरिक अम्ल बेकिंग पाउडर बनाने में काम आता है।
- कार्बोनिक अम्ल पेय पदार्थों में प्रयुक्त किया जाता है।
प्रश्न 3.
प्रबल अम्ल और दुर्बल अम्ल में अन्तर लिखिए।
उत्तर-
प्रबल अम्ल तथा दुर्बल अम्ल में अन्तर –
| प्रबल अम्ल | दुर्बल अम्ल |
| (i) ये पानी में मिलने से पूरी तरह H+ आयनों और ऋणात्मक आयनों में बदल जाते हैं। | (i) ये पानी में मिलने से पूरी तरह H+ आयनों और ऋणात्मक आयनों में नहीं बदलते। |
| (ii) इनमें साम्य स्थापना नहीं होती। | (ii) इनमें आयनों तथा अवियोजित अणुओं के बीच साम्य स्थापित हो जाता है। |
| (iii) उदाहरण-H2SO4, HNO3 | (iii) उदाहरण-H2CO3, CH3COOH |
प्रश्न 4.
प्रबल क्षारक (Strong base) और दुर्बल क्षारक (Weak base) में अन्तर लिखिए।
उत्तर-
प्रबल क्षारक तथा दुर्बल क्षारक में अन्तर-
| प्रबल क्षारक | दुर्बल क्षारक |
| ये पानी में पूरी तरह से घुल कर OH– आयन बनाते हैं। उदाहरण-NaOH, KOH | ये पानी में आंशिक रूप से घुलते हैं। उदाहरण-Ca(OH)2, Mg(OH)2. |
प्रश्न 5.
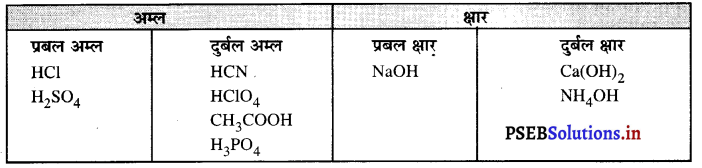
निम्न यौगिकों को दुर्बल एवं प्रबल अम्ल तथा क्षारक में वर्गीकृत कीजिए
(i) HCI
(ii) H2SO4
(iii) CH3COOH
(iv) HCN
(v) HClO4
(vi) H3PO4
(vii) NaOH
(viii) Ca(OH)2
(ix) NH4OH.
उत्तर-
प्रश्न 6.
क्षारकों/क्षारों के उपयोग लिखिए।
उत्तर-
- इनका उपयोग साबुन बनाने में किया जाता है।
- इन्हें क्षारीय बैटरियों में प्रयुक्त किया जाता है।
- ऐंटैसिड बनाने में प्रयोग में लाए जाते हैं।
- पेट्रोल रिफाइनिंग और कागज़ उद्योग में प्रयुक्त होते हैं।
- कपड़ों से ग्रीज़ के निशान हटाने में प्रयोग किया जाता है।
- कठोर जल को मृदु बनाने में प्रयोग किया जाता है।
प्रश्न 7.
क्षार और क्षारक में अंतर लिखिए।
उत्तर-
क्षार तथा क्षारक में अंतर-वे क्षारक जो जल में घुलनशील होते हैं उन्हें क्षार कहते हैं। इसका अर्थ है कि सभी क्षार क्षारक होते हैं पर सभी क्षारक क्षार नहीं होते। उदाहरण के लिए फैरिक हाइड्रॉक्साइड [Fe(OH)3] और क्यूपरिक हाइड्रॉक्साइड [Cu(OH)2] क्षारक हैं पर उन्हें क्षार नहीं कह सकते क्योंकि ये जल में घुलनशील नहीं है।
प्रश्न 8.
साधारण नमक के उपयोग लिखिए।
उत्तर-
- नमक हमारे भोजन का अनिवार्य भाग है।
- यह अनेक भोज्य पदार्थों को सुरक्षित रखने में काम आता है।
- यह साबुन उद्योग, पॉटरी आदि में प्रयुक्त होता है।
- यह हिमकारी मिश्रण बनाने में प्रयुक्त होता है।
- इस का उपयोग धावन सोडा, विरंजक चूर्ण, कास्टिक सोडा, हाइड्रोक्लोरिक अम्ल, मीठा सोडा आदि बनाने में किया जाता है।
![]()
प्रश्न 9.
विरंजक चूर्ण किस प्रकार तैयार किया जाता है ? इसके सामान्य गुण और उपयोग लिखिए।
उत्तर-
विरंजक चूर्ण का निर्माण शुष्क बुझे हुए चूने पर क्लोरीन की क्रिया से होता है।
Ca(OH)2 (s) + Cl2 (g) → CaOCl2 (s) + H2O (l)
बड़ी मात्रा में इसके निर्माण के लिए एक विशेष टावर लेते हैं जिसमें ऊपर से होपर (Hopper) से शुष्क बुझा हुआ चूना डाला जाता है और नीचे से क्लोरीन गैस तथा गर्म वायु प्रवाहित करते हैं। क्लोरीन ऊपर तक पहुँचतेपहुँचते पूर्णतया अवशोषित हो जाती है और बुझा हुआ चूना विरंजक चूर्ण में बदल जाता है।
गुण-
(i) विरंजक चूर्ण पीले रंग का चूर्ण है, जिसमें क्लोरीन की तीखी गंध होती है।
(ii) यह जल में घुलनशील है, परंतु पूरी तरह विलेय नहीं।
(iii) यह वायु की CO2 के साथ क्रिया करके क्लोरीन खो देता है।
CaoCl2 + CO2 → CaCO3 + Cl2 ↑
(iv) यह अम्लों से क्रिया करता है।
CaOCl2+ 2HCl → CaCl +H2O + Cl2
CaOCl2 + H2SO4 → CaSO4 + H2O + Cl2
उपयोग-
- कागज़ तथा कपड़ा उद्योग में विरंजक के रूप में।
- पेय जल को रोगाणुरहित करने में।
- बिना सिकुड़ने वाली ऊन बनाने में।
- यह क्लोरोफॉर्म बनाने में प्रयुक्त होता है।
- प्रयोगशाला में यह ऑक्सीकारक का कार्य करता है।
प्रश्न 10.
विरंजक चूर्ण की तैयारी के लिए समीकरण लिखें और इसके लाभ भी लिखें।
उत्तर-
रासायनिक समीकरण –
Ca(OH)2 (s) + Cl2 (g) → CaOCl2 (s) + H2O (l) विरंजक चूर्ण के लाभ-देखें
प्रश्न 11.
धोने का सोडा का रासायनिक सूत्र लिखिए। जब इसके क्रिस्टलों को वायु में खुला छोड़ देते हैं, तो क्या होता है?
उत्तर-
धोने का सोडा अर्थात् धावन सोडा (Washing Soda) का सूत्र Na2CO3 . 10H2O है जब इसके क्रिस्टलों को हवा में उद्भासित किया जाता है तब उत्फुल्लन प्रक्रिया से पानी के नौ अणु बाहर निकल जाते हैं।
Na2CO3 . 10H2O → Na2CO3 . H2O + 9 H2O
प्रश्न 12.
सोडियम हाइड्रोजन कार्बोनेट विलयन को गर्म करने पर क्या होता है? इसमें प्रयुक्त रासायनिक अभिक्रिया की समीकरण दीजिए।
उत्तर-
जब सोडियम हाइड्रोजन कार्बोनेट के घोल को गर्म किया जाता है तब वह कार्बन डाइऑक्साइड को उत्पन्न करता है और सोडियम कार्बोनेट को बनाता है।
![]()
प्रश्न 13.
CaOCl2 यौगिक का सामान्य नाम क्या है? उस पदार्थ का नाम बताइए जो क्लोरीन के साथ अभिक्रिया करके विरंजक चूर्ण प्रदान करता है।
उत्तर-
यौगिक CaOCl2 का सामान्य नाम विरंजक चूर्ण है। जिस पदार्थ के साथ क्रिया करके क्लोरीन विरंजक चूर्ण बनाता है उसका नाम बुझा हुआ चूना [Ca (OH)2] है।
प्रश्न 14.
बेकिंग सोडे के उपयोग लिखें।
उत्तर-
बेकिंग सोडे के उपयोग-
- इसका उपयोग बेकिंग पाऊडरों के बनाने में होता है।
- पेट की खराबी की अवस्था में यह औषधि का कार्य करता है।
- इसे अग्नि निवारक यंत्र में भी भरा जाता है।
प्रश्न 15.
क्या होता है जब ताज़े चूने के पानी में से कार्बन डाइऑक्साइड गैस गुज़ारी जाती है?
उत्तर-
जब ताज़े चूने के पानी में से थोड़ी मात्रा में कार्बन डाइऑक्साइड गैस गुज़ारी जाए तो अघुलनशील कैल्सियम कार्बोनेट के कारण उसका रंग दूधिया हो जाएगा –

इस घोल में यदि और कार्बन डाइऑक्साइड गैस गुज़ारी जाए तो यह कैल्सियम कार्बोनेट घुलनशील बाइकार्बोनेट ‘ में बदल जाएंगे जिससे चूने के पानी का दूधियापन समाप्त हो जाएगा-

![]()
प्रश्न 16.
pH स्केल क्या है ? यह किसी विलयन की अम्लता और क्षारकता कैसे दर्शाता है ? एक चित्र की सहायता से pH तथा [H3O]+ के पूरे परिसर को प्रकट कीजिए।
उत्तर-
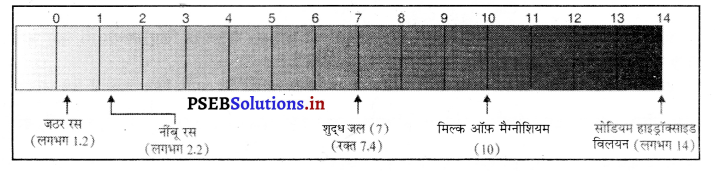
किसी विलयन में उपस्थित हाइड्रोजन आयन की सांद्रता ज्ञात करने के लिए जिस स्केल का प्रयोग किया जाता है इसे pH स्केल कहते हैं। इसमें ‘p’ ‘पुसांस’ (potenz) को प्रकट करता है जो एक जर्मन शब्द है और इसका अर्थ ‘शक्ति’ होता है। इस स्केल से शून्य से 14 तक pH को ज्ञात किया जा सकता है। शून्य अधिक अम्लता को तो 14 अधिक क्षारीयता को प्रकट करता है। pH को एक ऐसी संख्या के रूप में देखा जाता है जो किसी विलयन की अम्लता और क्षारीयता को दर्शाता है। हाइड्रोनियम आयन की सांद्रता जितनी अधिक होगी उसका pH उतना ही कम होगा। किसी उदासीन विलयन के pH का मान 7 होता है। 7 से कम मान अम्लीय विलयन और 7 से अधिक क्षारीय शक्ति को प्रकट करते हैं। सामान्य रूप से pH सार्वजिक सूचक अंतर्भारित पेपर द्वारा ज्ञात किया जाता है।
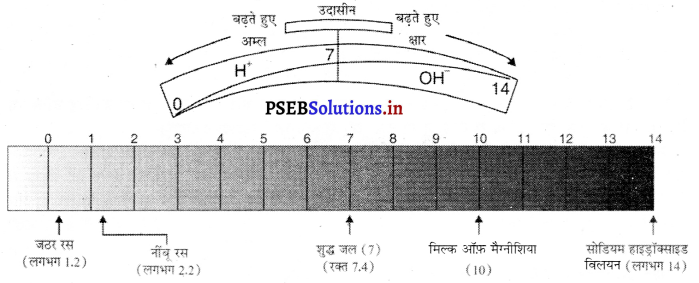
कुछ सामान्य पदार्थों को pH पत्र पर दिखाया गया है।
प्रश्न 17.
चित्र में दर्शाए pH पेपर पर नींबू के रस का pH = 2.2 तथा मिल्क आफ मैग्नीशिया का pH = 10 है। इससे क्या तात्पर्य है ?
उत्तर-
नींबू के रस का pH = 2.2 है जोकि 7 से कम है। अम्लीय प्रकृति तथा 7 से अधिक pH वाला मिल्क ऑफ मैग्नीशियम (pH = 10) क्षारीय प्रकृति का है।
प्रश्न 18.
धावन सोडा किस प्रकार तैयार किया जाता है ? इसके उपयोग लिखिए।
उत्तर-
धावन सोडा (Na2CO3.10H2O) एक रसायन जिसे सोडियम क्लोराइड से प्राप्त किया जा सकता है। बेकिंग सोडा को गर्म करके सोडियम कार्बोनेट प्राप्त किया जा सकता है। सोडियम कार्बोनेट के पुनः क्रिस्टलीकरण से धोने का सोडा प्राप्त होता है। यह भी एक क्षारकीय लवण है।
Na2CO3+ 10H2O → Na2CO3.10H2O (सोडियम कार्बोनेट)
सोडियम कार्बोनेट एवं सोडियम हाइड्रोजन कार्बोनेट, कई औद्योगिक प्रक्रियाओं के लिए उपयोगी रसायन है।
धावन सोडे के उपयोग
- सोडियम कार्बोनेट का उपयोग काँच, साबुन एवं कागज़ उद्योगों में होता है।
- इसका उपयोग बोरेक्स जैसे सोडियम यौगिक के उत्पादन में होता है।
- सोडियम कार्बोनेट का उपयोग घरों में साफ-सफाई के लिए होता है।
- जल की स्थाई कठोरता को हटाने के लिए इसका उपयोग होता है।
प्रश्न 19.
उत्फुल्लन क्या होता है? एक ऐसे यौगिक का नाम दीजिए जो उत्फुल्लन प्रदर्शित करता हो। अपने उत्तर को एक अभिक्रिया द्वारा समझाइए।
उत्तर-
उत्फुल्लन-उत्फुल्लन उस क्रिया को कहते हैं जिसमें किसी यौगिक क्रिस्टल जल के वायु में मुक्त होने की प्रक्रिया होती है। यह क्रिया गर्म करने या अपने आप ही हो जाती है। धावन सोडा में क्रिस्टलीय जल मिला होता है इसीलिए उसका सूत्र Na2CO3 . 10H2O है। जब इसे वायु में रखा जाता है तो यह पानी के 9 अणु खो देता है और एकल हाइड्रेट के रूप में रह जाता है।
Na2CO3 . 10H2O → Na2CO3.H2O + 9H2O
गर्म करने पर यह अपने सारे क्रिस्टलीय जल को खो देता है, Na2CO3 . 10H2O → Na2CO3 + 10H2O
प्रश्न 20.
एक बेकर ने पाया कि उसके द्वारा बनाया केक सख्त और आकार में छोटा है। वह कौन-सा संघटक डालना भूल गया है जिससे केक फूला हुआ बन सकता था? कारण बताइए।
उत्तर-
केक तैयार करते समय बेकरी वाला बेकिंग पाऊडर डालना भूल गया था। जब बेकिंग पाऊडर (सोडियम बाइकार्बोनेट और टारटारिक अम्ल का मिश्रण) डाल कर गर्म किया जाता है तब टारटारिक अम्ल की क्रिया से सोडियम बाइकार्बोनेट, कार्बन डाइऑक्साइड उत्पन्न करता है। इस कार्बन डाइऑक्साइड से केक फूलता है और हल्का होता है। बेकरी वाले का केक सख्त और आकार में छोटा है इसलिए निश्चित है कि वह बेकिंग पाऊडर डालना भूल गया है।
प्रश्न 21.
विरंजक चूर्ण को वायु में खुला छोड़ देने पर क्या होता है?
उत्तर-
जब विरंजक चूर्ण को वायु में उद्भासित किया जाता है तो वह अपने गुणों में विकृति पाता है। वायु में उपस्थित CO2 इससे क्रिया करता है जिस कारण कैल्सियम कार्बोनेट और क्लोरीन गैस उत्पन्न होते हैं। विरंजक चूर्ण के गुण नष्ट हो जाते हैं।
CaOCl2 + CO2 → CaCO3 + Cl2
![]()
प्रश्न 22.
अस्पतालों (Hospitals) में टूटी हुई अस्थियों को जोड़कर बैठाने के लिए उपयोग में लाए जाने वाले यौगिक का नामोल्लेख कीजिए। इसको कैसे निर्मित करते हैं?
उत्तर-
अस्पतालों में टूटी हुई हड्डियों को जोड़ने के लिए जिस यौगिक का प्रयोग किया जाता है उसे प्लास्टर ऑफ़ पेरिस कहते हैं। इसे रासायनिक दृष्टि से कैल्सियम सल्फेट हेमी हाइड्रेट (CaSO4 \(\frac{1}{2}\) H2O) कहते हैं। इसे भट्ठी में जिप्सम को 373 K ताप पर गर्म करके बनाया जाता है।

प्रश्न 23.
प्लास्टर ऑफ पेरिस का रासायनिक सूत्र और लाभ लिखो।
उत्तर-
प्लास्टर ऑफ पेरिस का रासायनिक सूत्र-
CaSO4 \(\frac{1}{2}\) H2O प्लास्टर ऑफ पेरिस के लाभ-
- इसे साँचे, खिलौने, सिरेमिक, बर्तन आदि बनाने में प्रयुक्त किया जाता है।
- सजावटी समान, मूर्तियां आदि इससे बनाए जाते हैं।
- अस्पतालों में अस्थि विभाग और दंत विभाग के द्वारा इसका पर्याप्त प्रयोग किया जाता है। यह टूटी हुई हड्डियों को जोड़ने के लिए प्रयुक्त किया जाता है और टूटे हुए दाँतों के स्थान पर नकली दाँत लगाने के सांचे इससे बनाए जाते हैं।
- भवनों की दीवारों और छतों को समतल करने और उन पर डिज़ाइन बनाने के लिए इसका प्रयोग किया जाता है।
- अग्निशमन संबंधी सामग्री इससे तैयार की जाती है।
- प्रयोगशालाओं में गैसों का रिसाव इससे रोका जाता है।
प्रश्न 24.
अनेक लोग पेट में गैस की शिकायत करते हैं। इसका मुख्य कारण क्या है ? इससे आराम पाने के लिए लोग ‘मिल्क ऑफ़ मैग्नीशियम’ का उपयोग क्यों करते हैं?
अथवा
ऐंटएसिड किसे कहते हैं ?
उत्तर-
आमाशय में जठर रस स्रावित होता है जिसमें एंजाइम पेप्सिन और हाइड्रोक्लोरिक अम्ल होता है। एंजाइम पेप्सिन अम्लीय माध्यम में ही सक्रिय होता है। जब हाइड्रोक्लोरिक अम्ल अधिक मात्रा में स्रावित होता है तब यह आमाशय में जलन उत्पन्न करता है जिसे गैस (Acidity) कहते हैं।
अम्ल की अधिकता को उदासीन करने के लिए जिन पदार्थों का प्रयोग किया जाता है उन्हें ऐंटएसिड (Antacids) कहते हैं। प्रायः लोग ‘मिल्क मैग्नीशियम’ प्रयोग करते हैं जो एक दुर्बल क्षारक है। यह अधिक अम्ल को उदासीन करके आराम पहँचाता है।
प्रश्न 25.
दाँतों की रक्षा के लिए दाँत किस प्रकार की टूथपेस्ट से साफ़ करने चाहिए? क्यों?
अथवा
pH परिवर्तन कैसे दंत-क्षय का कारण है ?
उत्तर-
खाना खाने के पश्चात् मुँह में शर्करा आदि की अधिकता के कारण भोजन के कण आदि जीवाणुओं द्वारा अम्लों में बदल दिए जाते हैं जिससे मुँह का pH कम हो जाता है जो दंत क्षय को उत्पन्न करता है। भोजन के बाद दाँतों की रक्षा के लिए क्षारीय टूथपेस्ट या टूथमंजन का प्रयोग करना चाहिए। इसमें उपस्थित दुर्बल क्षार अतिरिक्त अम्ल को उदासीन कर देते हैं। इससे दंत क्षय की संभावना कम हो जाती है।
प्रश्न 26.
अम्लीय वर्षा क्या है ? मिट्टी की pH को कैसे ज्ञात किया जाता है ?
उत्तर-
अम्लीय वर्षा-वातावरण में उपस्थित SO2, SO3, NO2, आदि गैसों का वर्षा के जल में घुल कर धरती पर वापिस गिरना अम्लीय वर्षा कहलाता है। मिट्टी का pH सार्वत्रिक सूचक अंतर्भारित पेपर द्वारा ज्ञात किया जाता है। इससे मिट्टी की अम्लीय या क्षारीय प्रकृति का पता लग जाता है। वर्षा के जल की pH मान जब 5.6 से कम हो जाती है तो वह अम्लीय वर्षा कहलाती है। मिट्टी का pH ज्ञात करने के लिए परखनली में मिट्टी को घोल कर निस्यंद एकत्रित कर लिया जाता है और सार्वत्रिक सूचक पत्र से pH की जाँच कर ली जाती है।
प्रश्न 27.
दन्त क्षरण क्या होता है ? यह कैसे होता है ?
उत्तर-
दन्त क्षरण-खाना खाने के पश्चात् मुँह में शर्करा की अधिकता होने पर जीवाणुओं द्वारा भोजन के कण अम्लों में बदल दिये जाते हैं जिससे pH का मान 5.5 से कम हो जाता है जो दन्त क्षरण का कारण बन जाता है।
प्रश्न 28.
धावन सोडे का रासायनिक नाम और सूत्र लिखो। इसके दो लाभ भी लिखो।
उत्तर-
धावन सोडे का रासायनिक नाम : सोडियम कार्बोनेट धावन सोडे का रासायनिक सूत्र : -Na2CO3.10H2O धावन सोडे के लाभ-
- इसका उपयोग कांच, साबुन और कागज़ उद्योगों में होता है।
- जल की स्थाई कठोरता को दूर करने के लिए इसका उपयोग होता है।
![]()
प्रश्न 29.
धावन सोडा (Washing Soda) के दो उपयोग लिखें।
उत्तर-
जब ताज़े चूने के पानी में से थोड़ी मात्रा में कार्बन डाइऑक्साइड गैस गुज़ारी जाए तो अघुलनशील कैल्सियम कार्बोनेट के कारण उसका रंग दूधिया हो जाएगा –

इस घोल में यदि और कार्बन डाइऑक्साइड गैस गुज़ारी जाए तो यह कैल्सियम कार्बोनेट घुलनशील बाइकार्बोनेट ‘ में बदल जाएंगे जिससे चूने के पानी का दूधियापन समाप्त हो जाएगा-

प्रश्न 30.
नीचे दिए चित्र में 1 और 2 को अंकित करें।
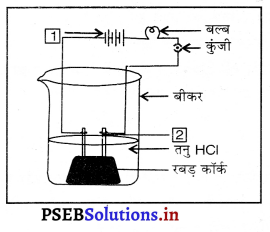
उत्तर-
- बैटरी (ऊर्जा स्रोत)
- एनोड।
प्रश्न 31.
आयोडीन युक्त नमक के उपयोग की सलाह क्यों दी जाती है ?
उत्तर-
भोजन में आयोडीन की कमी से घंघा रोग (Goitre) हो जाता है। इस रोग से बचने के लिए भोजन में आयोडीन युक्त नमक की सलाह दी जाती है।
अति लघु उत्तरात्मक प्रश्न (Very Short Answer Type Questions)
प्रश्न 1.
भोजन का खट्टा स्वाद किस कारण होता है ?
उत्तर-
अम्लों की उपस्थिति के कारण।
प्रश्न 2.
कड़वे स्वाद का कारण कौन होता है ?
उत्तर-
क्षारकों की उपस्थिति।
प्रश्न 3.
जिंक की सोडियम हाइड्रोक्साइड से क्रिया करने पर कौन-सी गैस उत्पन्न होती है?
उत्तर-
हाइड्रोजन गैस।
प्रश्न 4.
धातु कार्बोनेट और धातु हाइड्रोजन कार्बोनेट अम्लों से क्रिया करके कौन-सी गैस उत्पन्न करते हैं?
उत्तर-
कार्बन डाइऑक्साइड।
प्रश्न 5.
चूने के पानी से CO2 को प्रवाहित करने से क्या होता है?
उत्तर-
चूने का पानी दूधिया हो जाता है।
![]()
प्रश्न 6.
चूने के पानी से अधिक CO2 गुज़ारने से चूने के पानी का दूधियापन किस कारण समाप्त हो जाता है?
उत्तर-
जल में विलयशील Ca (HCO3)2 के कारण।
प्रश्न 7.
अधात्विक ऑक्साइड किस प्रकृति के होते हैं ?
उत्तर-
अम्लीय प्रकृति के।
प्रश्न 8.
अम्लों में से विद्युत्-प्रवाह किस कारण होता है ?
उत्तर-
आयनों के कारण।
प्रश्न 9.
अम्लीय विलयन किस आयन को उत्पन्न करता है?
उत्तर-
हाइड्रोजन आयन (H+) को उत्पन्न करता है।
प्रश्न 10.
क्षारक जल में कौन-सा आयन उत्पन्न करते हैं?
उत्तर-
हाइड्रॉक्साइड (OH–) आयन।
प्रश्न 11.
क्षार क्या है?
उत्तर-
जल में घुलनशील क्षारक को क्षार कहते हैं।
प्रश्न 12.
अम्लों को तनु करने के लिए क्या करना चाहिए?
उत्तर-
जल में सांद्र अम्ल धीरे-धीरे मिलाना चाहिए न कि सांद्र अम्ल में जल।
प्रश्न 13.
pH स्केल क्या है?
उत्तर-
किसी विलयन में उपस्थित हाइड्रोजन आयन की सांद्रता ज्ञात करने की स्केल को pH स्केल कहते हैं।
![]()
प्रश्न 14.
pH स्केल से कहाँ से कहाँ तक pH ज्ञात कर सकते हैं ?
उत्तर-
0 से 14 तक।
प्रश्न 15.
किसी उदासीन विलयन के pH का मान क्या होगा?
उत्तर-
pH का मान 7 होगा।
प्रश्न 16.
pH स्केल में विलयन का मान 7 से कम हो तो वह क्या दर्शाता है?
उत्तर-
अम्लीय विलयन।
प्रश्न 17.
pH स्केल में विलयन का मान 7 से अधिक हो तो वह क्या दर्शाता है?
उत्तर-
विलयन में OH की सांद्रता अर्थात् क्षार की बढ़ती शक्ति।
प्रश्न 18.
नींबू का रस pH स्केल पर क्या मान दिखाता है?
उत्तर-
लगभग 2.2.
प्रश्न 19.
मिल्क ऑफ मैग्नीशियम pH स्केल पर क्या मान दिखाता है?
उत्तर-
10.
प्रश्न 20.
सोडियम हाइड्रोक्साइड pH स्केल पर क्या मान दिखाता है?
उत्तर-
लगभग 14.
प्रश्न 21.
शुक्र ग्रह का वायुमंडल किससे घिरा है?
उत्तर-
सल्फ्यूरिक अम्ल के मोटे श्वेत और पीले बादलों से।
प्रश्न 22.
हमारा उदर कौन-सा अम्ल उत्पन्न करता है?
उत्तर-
हाइड्रोक्लोरिक अम्ल।
प्रश्न 23.
पेट में अधिक अम्ल का उपचार कैसे किया जाता है?
उत्तर-
ऐटैसिड जैसे क्षारकों द्वारा।
प्रश्न 24.
मुँह में दाँतों का क्षय कब आरंभ होता है?
उत्तर-
pH का मान 5.5 से कम होने पर।
![]()
प्रश्न 25.
डंक मारे गए अंग पर किसके उपयोग से आराम मिलता है ?
उत्तर-
बेकिंग सोडा जैसे दुर्बल क्षारक से।
प्रश्न 26.
सिरके में कौन-सा अम्ल उपस्थित होता है?
उत्तर-
ऐसीटिक अम्ल।
प्रश्न 27.
दही और खट्टे दूध में कौन-सा अम्ल होता है ?
उत्तर-
लैक्टिक अम्ल।
प्रश्न 28.
ऊष्मा उन्मोची क्रियाएँ (Exothermic Reactions) किसे कहते हैं?
उत्तर-
ऊष्मा उन्मोची क्रियाएं-जिन रासायनिक क्रियाओं में ऊष्मा ऊर्जा की उत्पत्ति होती है उन्हें ऊष्मा उन्मोची क्रियाएँ कहते हैं।
प्रश्न 29.
ऊष्मा अवशोषी (Endothermic Reaction) क्रिया किसे कहते हैं ?
उत्तर-
ऊष्मा अवशोषी क्रियाएं-जिन रासायनिक क्रियाओं में ऊष्मा का अवशोषण होता है उन्हें ऊष्मा अवशोषी क्रिया कहते हैं।
प्रश्न 30.
ठोस रूप में सोडियम क्लोराइड (NaCl) विद्युत् का चालक क्यों नहीं होता?
उत्तर-
ठोस सोडियम क्लोराइड में Na+ और Cl– तीव्र कूलॉम बलों से आपस में जुड़े रहते हैं और इसमें कोई भी स्वतंत्र आयन नहीं होता, जिस कारण वह विद्युत् का चालक नहीं होता।
प्रश्न 31.
विलेय किसे कहते हैं ?
उत्तर-
विलेय वह यौगिक है, जो जलीय अवस्था में आकर धनात्मक या ऋणात्मक आवेशित आयनों में परिवर्तित हो जाता है।
प्रश्न 32.
शक्तिशाली विलायक (Strong Electrolyte) किसे कहते हैं ?
उत्तर-
वह यौगिक जिसके जलीय घोल की विच्छेदन मात्रा 30% हो उसे शक्तिशाली विलायक कहते हैं।
![]()
प्रश्न 33.
कमज़ोर विलायक (Weak Electrolytes) किसे कहते हैं ?
उत्तर-
वह यौगिक जिसके जलीय घोल की विच्छेदन मात्रा 30% से कम हो उसे कमज़ोर विलायक कहते हैं।
प्रश्न 34.
बेकिंग पाऊडर किसे कहते हैं ?
उत्तर-
बेकिंग पाऊडर मीठा सोडा और टारटैरिक अम्ल के मिश्रण को कहते हैं।
प्रश्न 35.
केक बनाने के लिए बेकिंग पाऊडर में यदि टारटैरिक अम्ल का प्रयोग न किया जाए तो केक का स्वाद कैसा होगा?
उत्तर-
सोडियम कार्बोनेट की उपस्थिति के कारण वह कड़वा होगा।
प्रश्न 36.
अग्निशमन के लिए यंत्रों में किन रसायनों का प्रयोग किया जाता है?
उत्तर-
सोडियम हाइड्रोजन कार्बोनेट और सल्फ्यूरिक अम्ल का।
प्रश्न 37.
सोडा-एसिड अग्निशमन यंत्रों से कौन-सी गैस उत्पन्न होती है?
उत्तर-
कार्बन डाइऑक्साइड गैस।
प्रश्न 38.
जल को संक्रमण रहित बनाने में किस यौगिक का सामान्यतः प्रयोग किया जाता है?
उत्तर-
विरंजक चूर्ण (CaOCl2) का।
प्रश्न 39.
विरंजक चूर्ण से किस गैस की गंध आती है?
उत्तर-
क्लोरीन गैस की गंध।
प्रश्न 40.
कई बार तरण-तालों में तैरने से आँखें लाल हो जाती हैं। क्यों ?
उत्तर-
पानी में विरंजक चूर्ण की अधिकता के कारण आँखें लाल हो जाती है।
प्रश्न 41.
इमली तथा चींटी के डंक में कौन-कौन से अम्ल होते हैं ?
उत्तर-
इमली में उपस्थित अम्ल : टारट्रिक अम्ल चींटी के डंक में उपस्थित अम्ल : मेथेनॉइक अम्ल।
प्रश्न 42.
सभी अम्लों एवं क्षारकों में क्या समानताएं होती हैं ?
उत्तर-
(i) अम्ल तथा क्षारक कुछ एक धातुओं के साथ क्रिया करके हाइड्रोजन बनाते हैं।
(ii) अम्ल तथा क्षारक पानी में घुलकर हाइड्रोनियम H3O+ /OH– आयन बनाते हैं। ये विलयन की प्रक्रिया ऊष्माक्षेपी है।
वस्तुनिष्ठ प्रश्न (Objective Type Questions)
बहु-विकल्पीय प्रश्न
प्रश्न 1.
अम्लीय विलयन का pH मान होता है
(a) pH >7
(b) pH <7
(c) pH = 7
(d) pH = 14.
उत्तर-
(b) pH <7.
प्रश्न 2.
उदासीन विलयन की pH है
(a) 7
(b) >7
(c) <7
(d) 14.
उत्तर-
(a) 7.
प्रश्न 3.
Na2CO3 का प्रचलित नाम है –
(a) ब्लीचिंग पाउडर
(b) बेकिंग पाउडर
(c) प्लास्टर ऑफ पेरिस
(d) वाशिंग सोडा।
उत्तर-
(d) वाशिंग सोडा।
![]()
प्रश्न 4.
अम्ल तथा क्षारक की अभिक्रिया के फलस्वरूप लवण तथा जल प्राप्त होते हैं। इस अभिक्रिया को कहते हैं
(a) उदासीनीकरण
(b) तनुकरण
(c) क्लोर क्षार
(d) कोई भी नहीं।
उत्तर-
(a) उदासीनीकरण।
प्रश्न 5.
डाक्टर टूटी हुई हड्डियों को सही जगह पर स्थिर रखने के लिए किसका उपयोग करते हैं ?
(a) सीमेंट
(b) जिप्सम
(c) प्लास्टर ऑफ पैरिस
(d) सोडा।
उत्तर-
(c) प्लास्टर ऑफ पैरिस।
रिक्त स्थानों की पूर्ति कीजिए-
(i) जल में घुलनशील क्षारक को ………………. कहते हैं।
उत्तर-
क्षार
(ii) सल्फर को वायु में जलाने पर प्राप्त गैस की प्रकृति ……………………. होगी।
उत्तर-
अम्लीय
(iii) अम्लीय विलयन का pH मान 7 से …………………………… होता है।
उत्तर-
कम
(iv) धातुएँ अम्ल के साथ अभिक्रिया करके …………………………. गैस बनाती हैं।
उत्तर-
हाइड्रोजन
(v) क्षार का जलीय विलयन ………… को नीला करता है।
उत्तर-
लाल लिटमस।